
생화학분자생물학회입니다.
Membrane Protein Structural and Functional Biology Laboratory
작성자
관리자작성일자
2020-07-17조회수
1399Membrane Protein Structural and Functional Biology Laboratory
진미선
광주과학기술원 생명과학부
[연구실소개]
우리 몸 전체 단백질의 30%를 차지하고 있는 세포막 단백질 (membrane protein)은 다양한 신호 전달 물질을 인식하여 이를 세포에 전달하거나, 세포막 내외로의 이온 및 물질 수송을 매개하여 우리 몸의 여러 기관에서 생명 보존에 필수적인 역할을 수행한다. 따라서 이들의 돌연변이 및 기능 이상은 암, 대사관련질환, 퇴행성 뇌질환 등 다양한 질병의 직접적 원인이 된다. 이러한 생물학적 중요성으로 인해 현재 시판 중이거나 개발 중인 바이오 의약품의 약 50% 이상이 세포막 단백질을 표적으로 하고 있을 정도로 세포막 단백질은 신약 개발 산업의 핵심 분야이다. 본 연구실에서는 신약 개발의 주요 표적인 세포막 단백질의 고해상도 구조를 X-선 결정학 (X-ray crystallography), 초저온 전자현미경 (Cryo-electron microscopy) 방법으로 규명할 뿐만 아니라 분자생물학 및 생화학적인 접근을 통한 기능 연구를 병행하고 있다. 이를 바탕으로 표적 단백질의 작용 메카니즘을 분자 수준에서 연구하며, 관련 질병을 치료할 수 있는 신약후보물질 및 새로운 바이오 의약품 개발의 기반을 마련하고자 한다.
[연구내용]
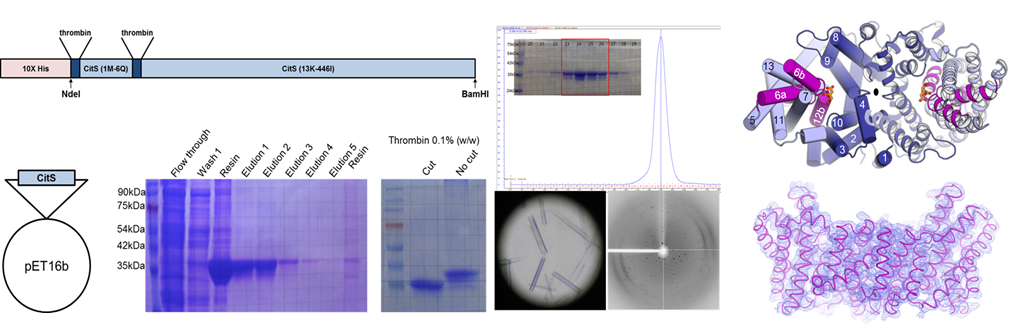
1. 당뇨 및 비만 표적 단백질 CitS (시트르산 트랜스포터) 구조 연구
시트르산(Citrate)은 거의 모든 생명체에서 없어서는 안 되는 중요한 생체 조절 분자이다. 대표적으로 박테리아에서는 시트르산을 이용해 에너지를 생성하고, 초파리에서는 지방 합성을 위한 전구 물질로 이용하며, 사람에서는 해당 과정과 지방산 합성에 이용된다. 인간에게서 세포 내로의 시트르산 수송에 관여하는 단백질에는 SLC13 패밀리가 있으며, 그 중 NaCT (SLC13A5, mammalian INDY)가 가장 많이 연구되고 있다. NaCT는 해당 과정과 지방산 합성이 일어나는 간세포에서 주로 발현된다. 현재까지 NaCT 단백질의 구조는 규명된 바가 없고, 그로 인해 이들이 어떠한 분자생화학적 원리에 의해 시트르산과 결합하고 세포 내로 이동시키는지에 대한 정확한 작용 기작은 여전히 가설 수준에 머무르고 있다. 본 연구에서는 세포내 시트르산 수송 기전을 분자수준에서 규명하기 위해 NaCT 뿐만 아니라, 구조 및 기능적으로 매우 유사한 박테리아 Klebsiella pneumonia CitS (KpCitS)를 모델시스템으로 이용하여 수송 싸이클 동안 시트르산 결합에 따른 구조 변화를 규명하고, 이에 기반하여 시트르산 수송 메커니즘을 제시하였다 (그림1). KpCitS의 구조 연구를 통해 KpCitS가 이합체 (homodimer)로 이루어져 있으며, 각각의 단량체 (monomer)는 기능적으로 시트르산 수송에 관여하는 도메인 (transport domain)과 구조 유지에 중요한 역할을 하는 도메인 (dimerization domain)으로 나누어져 있는 것을 알게 되었다. 또한 수송 싸이클 동안 수송 도메인은 세포막을 중심으로 움직이면서 시트르산을 세포 내로 운반하는 역할을 하는 반면, 구조 유지 도메인은 시트르산이 운반되는 동안 구조변화 없이 고정되어 있는 것을 관찰하였다.
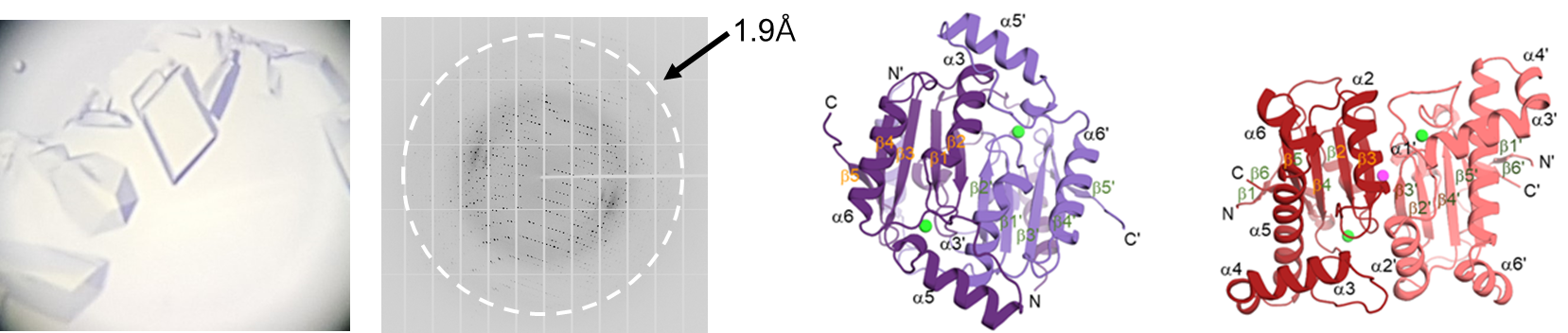
2. 탄산탈수소효소 (carbonic anhydrase) 구조 및 기능 연구
탄산탈수소효소 (carbonic anhydrase, CA)는 이산화탄소와 물이 반응하여 탄산수소이온 (bicarbonate) 과 수소이온으로 바뀌는 화학반응을 촉매하는 효소이다. CA는 현재 유전자 서열 및 구조적 유사성에 따라 총 7개의 패밀리로 나뉘고 있으며, 그 중 alpha와 beta 그룹의 구조 연구가 가장 활발히 진행되었다. alpha-CA와 달리 beta-CA는 인간에게서 발현되지 않으며, 병원성 박테리아 및 균류의 성장, 분화에 직접적으로 관련되어 있어 이를 타겟으로 하는 항생제 개발 연구가 활발히 진행되고 있다. 아스페르길루스증은 면역력이 저하된 사람에게 발견되는 치명적인 폐질환으로, 진단 후 12시간 내에 사망률이 30%에 달한다. 아스페르길루스증을 유발하는 주요 병원균인Aspergillus fumigatus는 총 4개의 beta-CA (CafA, CafB, CafC, CafD)를 갖고 있으며, 여러 기능 및 돌연변이 실험을 통해 CafA와 CafB는 개체 성장 및 포자 형성에 중요한 역할을 하는 반면, CafC와 CafD는 별다른 영향을 미치지 못하는 것으로 확인되었다. 본 연구팀은 CafA와 CafB는 다른 beta-CA와 마찬가지로 높은 이산화탄소 가수분해 활성을 보이는 반면, CafC와 CafD는 활성이 거의 없는 것을 확인하였다. 본 연구에서는 CafC와 CafD의 활성이 낮은 이유를 구조 및 돌연변이 실험을 수행하여 규명하였다 (그림2). 본 연구는 처음으로 낮은 활성을 보이는 beta-CA 탄산탈수소효소의 구조를 밝힌 연구로, 낮은 촉매 활성에 대한 분자 기전 이해를 가능하게 하였다.
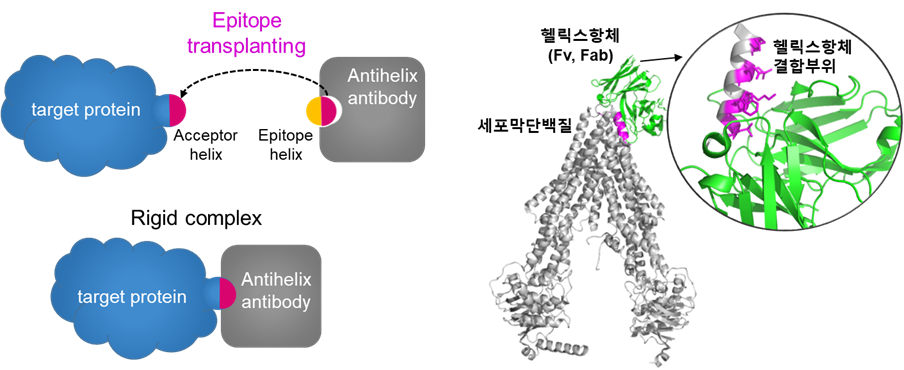
3. 구조 연구용 알파 헬릭스 항체 개발
항체는 구조 연구가 어려운 세포막 단백질에 결합하여 단백질의 생화학적 성질을 변형시켜 주기 때문에 구조 규명을 용이하게 만들 수 있다. 하지만 이러한 응용 가능성이 높음에도 불구하고 항체를 이용한 단백질 구조 연구는 여전히 활발하지 못하다. 그 이유는 단일클론항체를 생산하는데 많은 비용과 시간이 소요되며, 항체 생산에 필요한 수mg 수준의 정제된 표적 단백질 생산이 어렵기 때문이다. 본 연구에서는 이러한 문제점을 해결하기 위하여, 포스텍 이지오 교수님과의 공동연구를 통해 기존에 이미 개발된 항체가 전혀 다른 구조의 새로운 표적에도 결합할 수 있도록 항체 엔지니어링 기술을 개발하였다. 알파헬릭스 구조는 대부분의 단백질이 가지고 있는 이차 구조이며, 서열만 서로 다를 뿐 대부분의 경우 거의 유사한 구조를 가지고 있다. 세포막 단백질은 거의 모두 알파헬릭스 구조로 이루어져 있기 때문에 표적 단백질이 갖고 있는 헬릭스 부분의 아미노산 서열을 기존의 항체에 결합하는 서열로 바꾸어 주면 항체 재사용이 가능하게 된다 (그림3). 본 연구에서는 이러한 특성을 이용하여 세포막 단백질에 알파헬릭스 결합부위를 이식하면 기존 헬릭스 항체와 충분히 결합한다는 것을 pull-down assay, size exclusion chromatography 실험을 통해 증명하였다.
[연구책임자]

진미선 교수
주소: 광주광역시 북구 첨단과기로 123 광주과학기술원 생명과학부 407호
전화: 042-715-3562
팩스: 042-715-2484
E-mail: misunjin@gist.ac.kr
Homepage: https://life.gist.ac.kr/mpsf/index.do
[연구진구성]
교수: 진미선
박사후 연구원: 김송원
박사과정: 김수빈, 이상수
석박사 통합과정: 박준규, 최승훈, 주슬기
석사과정: 한현수

[대표논문]
1. Songwon Kim, Na Jin Kim, Semi Hong, Subin Kim, Jongmin Sung, and Mi Sun Jin (2019), The structural basis of the low catalytic activities of the two minor β-carbonic anhydrases of the filamentous fungus Aspergillus fumigatus, J Struc Biol, 208(1), 61-68
2. Ji Won Kim, Songwon Kim, Haerim Lee, Geunyoung Cho, Sun Chang Kim, Hayyoung Lee, Mi Sun Jin*, and Jie-Oh Lee* (2019), Application of antihelix antibodies in protein structure determination, PNAS, 116(36), 17786-17791
* indicates co-corresponding authors.
3. Subin Kim, Jongmin Sung, Jungyoon Yeon, Seung Hun Choi, and Mi Sun Jin (2019), Crystal Structure of a Highly Thermostable α-Carbonic Anhydrase from Persephonella marina EX-H1, Molecules and Cells, 42(6), 460-469
4. Jung-Ah Kang, Songwon Kim, Minji Park, Hyun-Jin Park, Jeong-Hyun Kim, Sanghyeok Park, Jeong-Ryul Hwang, Yong-Chul Kim, Yoon Jun Kim, Yuri Cho*, Mi Sun Jin* and Sung-Gyoo Park* (2019), Ciclopirox inhibits Hepatitis B Virus secretion by blocking capsid assembly, Nature Communications, doi: 10.1038/s41467-019-10200-5.
5. Bitnarae Kim, Seungsu Kim and Mi Sun Jin (2018), Crystal structure of the human glial fibrillary acidic protein 1B domain, Biochemical and Biophysical Research Communications, 503(4), 2899-2905
6. Ji Won Kim, Subin Kim, Songwon Kim, Haerim Lee, Jie-Oh Lee* and Mi Sun Jin* (2017), Structural insights into the elevator-like mechanism of the sodium/ citrate symporter CitS, Scientific Reports, doi: 10.1038/s41598-017-02794-x
첨부파일