암 대사 (Cancer Metabolism) 연구와 대사항암제 개발
박재형 박현우
연세대학교 생명시스템대학 생화학과 연세대학교 생명시스템대학 생화학과
jhpark.main@yonsei.ac.kr hwp003@yonsei.ac.kr
1. 서론
1920년대에 Otto Warburg에 의해 암세포가 산소가 충분한 환경에서도 glycolysis에 의존해 에너지를 합성한다는 사실이 보고되었다.(1) Otto Warburg는 암세포가 mitochondria 손상으로 인해 glycolysis 의존성을 획득한다고 주장하였으나, 이후 많은 연구들을 통해 암세포는 세포분열에 필요한 building block과 에너지를 효율적으로 합성하고자 glucose를 선호하며 이 과정에서 암세포의 mitochondria 에너지 생성 기능이 원활히 수행됨이 밝혀졌다.(2) 암세포의 핵심적인 성질인 통제되지 않는 세포분열을 위하여 암세포는 지속적으로 단백질, 핵산, 지질 등의 building block을 필요로 하며, 분열 과정에서 소모되는 막대한 에너지를 충당해야 한다. 따라서 암세포는 정상세포와 현저히 다른 대사적 양상을 가진다. 암은 oncogene과 tumor suppressor gene의 유전자 돌연변이에 의해 발생하며, 이러한 돌연변이들이 암세포의 비정상적 대사과정에 직/간접적으로 영향을 미치는 것으로 밝혀졌다. 예를 들어, 암에서 가장 흔하게 발견되는 c-Myc의 비정상적 활성화는 glutamine 대사과정을 촉진하며, p53의 돌연변이는 glucose와 glutamine 대사 효소의 발현과 활성을 조절하는 것으로 보고되었다.(3, 4) 더 나아가 최신 연구 결과에 따르면 암세포의 비정상적 대사 활성은 단지 유전자 돌연변이의 최종 산물인 것뿐만 아니라 변형된 대사 활동이 암의 성장과 악성화에 직접적으로 영향을 미친다. 이에 따라 현재 세계적으로 암 대사 제어 효소 및 분자 기전에 기반한 4세대 항암요법인 대사항암제 개발 관련 연구가 활발히 진행되고 있다. 본 총설에서는 암의 대사적 특징과 암 대사가 암의 악성화에 미치는 영향을 설명하고, 대사 기반 항암제 개발의 관점에서 암 대사를 분석하고자 한다.
2. 본론
1) 암의 대사적 특징
암세포를 둘러싼 종양미세환경(Tumor Microenvironment)은 열악한 혈관 형성으로 인해 만성적인 영양 결핍과 산소 부족 등의 문제가 있고, 암세포는 이에 적응하고 성장하기 위해 스스로의 대사체계를 변형시킴으로써 외부 영양분을 효율적으로 흡수하고, 대사 효소의 발현과 활성을 극대화한다.
(1) Glucose 대사
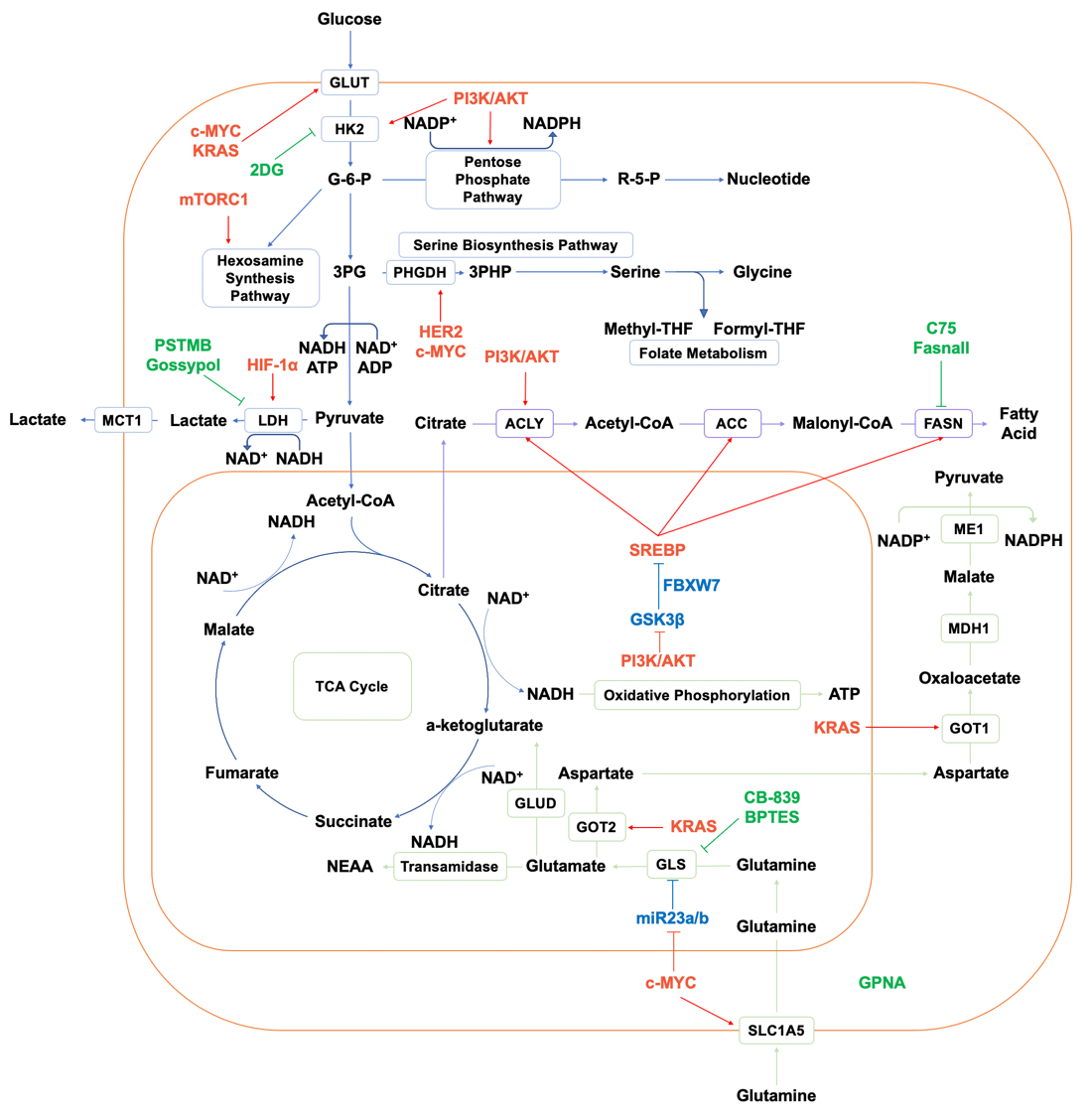
18-FDG를 사용하여 glucose uptake을 추적해 암을 찾아내는 PET-CT에서 볼 수 있듯이, 암세포는 glucose에 의존하는 대사체계를 갖는 것으로 알려졌다. Glucose는 세포 안에서 Glycolysis, Hexosamine synthesis pathway, Pentose phosphate pathway (PPP), Serine biosynthesis pathway 등 다양한 대사과정에 참여하여 아미노산, 핵산 및 지방산 생산의 주된 탄소 공급원으로 기능한다. 뿐만 아니라 Glycolysis와 Oxidative phosphorylation (OXPHOS)를 통해 ATP를 합성하여 에너지를 제공하기도 한다. 알려진 많은 암 유발 인자의 돌연변이들이 glucose 대사를 활성화하는 것으로 보고되었는데, c-Myc과 KRAS 등의 돌연변이들은 Glucose transporter인 GLUT의 발현을 증가시켜 세포 안으로 유입되는 glucose를 증가시키고, PI3K/AKT의 비정상적 활성은 Hexokinase 2의 발현을 증가시켜 해당과정을 효율적으로 증가시킨다.(5-7) 흥미롭게도 Warburg effect와 같이 암세포는 glycolysis에 의존하여 building block을 합성하는데, 이 과정의 지속을 위해 NAD+를 재생성하는 것이 중요하다. Lactate Dehydrogenase (LDH)라는 효소가 이 과정에 관여하는데, HIF-1α는 많은 종류의 암에서 LDH를 활성화하여 pyruvate을 lactate로 만들며 NAD+를 재생성하여 증가된 Glycolysis를 지속시킨다.(8) Glycolysis 이외에도 PI3K/AKT와 RAS는 PPP를 활성화하여 핵산 합성과 NADPH를 통한 Redox homeostasis를 유지시키고, mTORC1의 활성은 Hexosamine synthesis pathway를 활성화하는 것으로 알려졌다. Glycolysis에서 파생된 대사 과정인 Serine biosynthesis pathway는 Folate metabolism과 연계되어 methyl group과 핵산 합성의 전구체를 제공한다. 암세포에서 c-Myc은 PHGDH라는 효소를 활성화하여 serine 합성을 촉진한다(9). 이와 같이 암세포는 다양한 분자기전을 통해 glucose 대사를 활성화 시킨다.(그림 1)
(2) Glutamine 대사
최근 연구에 따르면 glucose 뿐 아니라 glutamine 또한 암세포의 중요한 대사물질로 밝혀지고 있는데, glucose와는 달리 glutamine은 암세포의 핵심 질소 공급원으로서 중요한 역할을 수행한다. 비필수 아미노산인 glutamine은 다른 아미노산 합성이나 지방질의 전구체가 되어 암세포의 성장에 기여한다. Glutamine은 SLC1A5 transporter에 의해 세포 안으로 들어오는데, c-Myc oncogene은SLC1A5 발현을 증가시켜 glutamine uptake을 촉진하고, Aerobic glycolysis의 최종 산물인 lactate 또한 세포 밖으로 배출시킴으로써 glutamine 대사를 활성화하는 것으로 밝혀졌다.(10, 11) 세포 안에서 glutamine은 Glutaminase (GLS) 효소에 의해 glutamate로 대사 되어 다양한 대사과정에 사용되는데, 암세포에서 c-Myc은 microRNA인 miR23a/b를 억제해 GLS 발현을 증가시키고 췌장암에서 KRAS 돌연변이는 glutamate을 세포질로 이동시켜 GOT1과 ME1을 통해 oxaloacetate와 NADPH를 합성해 세포의 ROS 조절 기전에 도움을 준다.(12, 13) Alanine, asparagine 등과 같은 아미노산 합성에 질소 공급원으로 사용되는 것 이외에 glutamine은 지방질 합성의 탄소 공급원으로도 사용된다. 특히 암세포는 Aerobic glycolysis로 인해 glucose로부터 acetyl-CoA를 합성하는 효율이 떨어진다. 하지만, acetyl-CoA는 지질 합성의 전구체가 되는 물질이기 때문에, 암세포는 glutamine으로부터 TCA cycle을 통해 acetyl-CoA를 합성함으로써 지질 생성을 시작한다.(그림 1)
그림 1. 다양한 암 유발 인자에 의한 암 대사 체계의 변화와 대사 항암제 개발 사례
(3) Fatty Acid 대사
세포막과 세포소기관의 막은 인지질 성분으로 구성되어 있기 때문에, 안정적으로 지방질을 합성 또는 흡수하여 공급하는 것이 암세포의 성장을 위해 필수적이다. 뿐만 아니라 DAG나 PIP3와 같은 지방질은 세포 내에서 Secondary messenger 역할을 수행하기도 한다. 지방질 합성은 전사인자 SREBP에 의해 조절되는데, SREBP에 의해 지방질 합성에 관여하는 ACLY, FASN 등 다양한 대사효소들의 발현이 조절된다. 일반적으로 SREBP는 GSK3와 E3 ligase인 FBXW7에 의해 ubiquitination 되어 분해된다.(14) 그러나 암세포에서 비정상적으로 활성화된 PI3K/AKT와 mTORC2에 의해 GSK3β가 억제되고, SREBP가 활성화된다.(15) 또한 AKT 신호전달경로는 지방질 합성의 첫 단계에 관여하는 효소인 ACLY를 인산화하여 지방산 합성 및 histone acetylation을 촉진한다.(16) 하지만 지방산을 합성하는 과정은 NADPH를 소모하여 세포에 oxidative stress를 유발할 수 있기 때문에, 유방암이나 자궁경부암의 경우 HIF-1α를 통해 지방산 수용체의 발현을 증가시킴으로써 de novo fatty acid 합성 대신 외부의 지방산을 흡수하는 방식으로 지방을 충족하기도 한다.(17)
2) 비정상적 대사 활동이 암 악성화에 미치는 영향
암 대사에 관한 최근의 연구들은 암세포의 대사적 변화가 세포 내 활성산소의 처리 뿐만 아니라 전이, 암 줄기세포의 발생, 그리고 약물 저항성에 이르기까지 광범위한 영역에서 암세포의 악성화에 영향을 미치는 것으로 밝혀지고 있다. 따라서 암의 대사 과정이 암세포 악성화에 기여하는 기전을 이해하는 것은 대사 기반 항암제 개발 전략 수립에 중요하다.
OXPHOS를 비롯한 다양한 대사 과정 중에서 ROS의 발생은 필연적으로 일어난다. 어느 정도의 ROS는 오히려 Genomic instability를 유발해 암세포의 성장을 돕는다는 보고들도 있지만, ROS의 축적은 세포 사멸을 유발하기 때문에 적절한 ROS 통제 기전이 필요하다. 세포는 PRXs 또는 GSH/GSSG system을 활용하여 세포 내의 활성산소를 조절하는데, 이 과정에서 NADPH를 환원제로 사용한다. 따라서 암세포는 Redox homeostasis를 유지하기 위해 NADPH를 합성하는 기전과 항산화 기능을 수행하는 효소의 발현을 촉진하는 것으로 보고되었다. 특히 많은 암 종에서 Redox homeostasis 유지의 핵심적인 요소인 NRF2의 활성이 증가해 있는 것으로 나타난다.(18) 정상적인 경우에 NRF2는 KEAP1과 상호작용하여 억제된 상태인데, 암세포는 KEAP1을 통한 NRF2 활성 조절을 우회하기 위해 KEAP1의 발현을 억제하는 전략을 취한다. 예를 들어, 비소세포폐암에서 KEAP1은 돌연변이가 있어 NRF2를 억제할 수 없고, 유방암에서는 KEAP1이 hypermethylation 되어 발현이 억제된 상태인 것이 보고된 바 있다.(19, 20) 암 대사는 NADPH를 높이는 방향으로도 Redox homeostasis에 기여하는데, 특히 췌장암에서 KRAS G12D 돌연변이는 glutamine으로부터 NADPH를 합성하는 기전을 활성화한다.
암의 비정상적 대사 과정은 암의 전이에도 중요한 역할을 하는 것으로 알려졌다. 특히 암은 전이를 위해 주변 조직으로 침윤하여, 혈관으로 유입되어 Circulating tumor cell (CTC)이 되고, 전이될 조직에 정착하여 전이암을 생성하는 과정을 거치는데 이 과정에서 각각 다른 대사경로를 활성화한다. 먼저 침윤의 단계에서 암세포는 EMT가 일어나는데, 흥미롭게도 Glycolysis가 이 과정에 관여한다. 특히 PFK1이라는 glycolysis 효소는 Hippo 신호전달경로의 effector인 YAP에 직접적으로 결합하여 YAP과 전사인자 TEAD 간의 결합을 촉진한다.(21) YAP-TEAD는 세포의 이동 및 EMT에 관한 유전자의 발현을 통해 세포의 침윤 과정에 기여한다. 혈관으로 들어간 암세포는 주변 조직과의 결합 없이 부유 상태로 생존해야 하는데, Anoikis resistance를 획득하기 위해 암세포는 ROS를 억제할 수 있는 기전을 활성화한다. 특히 HO-1은 Heme metabolism을 억제해 ROS를 억제하고 전이를 촉진하는 것으로 알려졌다.(22) 또한, 전이 과정에서는 PPP와 glutamine 대사를 통한 NADPH 합성 기전이 증가한다. 전이될 조직에서 암세포는 Colonization이 진행 되는데, 이 과정에서는 ATP 합성을 최대화하기 위한 대사적 전환이 발생한다. 특히 이 과정에서 PGC-1이 활성화되어 Metabolic platicity를 촉진함으로써 Glycolysis와 OXPHOS 모두를 통해 암 전이에 필요한 ATP를 합성하게 된다.(23)
암 대사는 암 줄기세포의 형성과 약물 저항성에도 영향을 미친다. 최근 연구들은 암세포 중에서도 self-renewal과 전이암을 형성 할 수 있는 줄기세포와 유사한 능력을 가진 암세포를 암줄기세포(Cancer stem cell, CSC)로 명명하여 그 특징을 연구 중인데, 대부분의 화학항암요법은 분열하는 암세포를 타겟으로 하기에, 빠르게 분열하지 않는 암줄기세포는 약물 저항성과 재발이 발생하는 주된 원인으로 여겨지고 있다.(24) 암줄기세포는 세포 표면에 어떤 마커가 발현하는지, 어떤 종양미세환경에 놓이는지에 따라 다양한 대사적 차이를 보이는 Metabolic platicity를 가지고 있기 때문에, 암의 종류와 혈중 영양소의 분포에 따라 다른 특징을 보인다. 예를 들어 glioblastoma 등의 암종에서 암줄기세포는 Glycolysis 효소의 발현은 증가시키나 OXPHOS는 억제하는 반면, PDAC이나 백혈병 줄기세포의 경우 OXPHOS에 더 의존적인 경우도 발견된다.(25, 26) 이러한 대사적 유동성은 암세포가 약물 저항성에 갖기 쉽도록 하는데, 현존하는 대부분의 표적치료 약물은 약물 저항성 문제가 큰 장애물로 여겨진다.
3) 4세대 대사항암제 개발
암 대사는 암의 다양한 특징에 영향을 미치는 요소로, 그 중요성이 강조되고 있다. 정상세포와 구분되는 암 특이적 대사체계를 항암 타겟으로 하여 암세포만 선별적으로 공격하는 약물을 개발할 수 있을 것이라는 기대가 커지고 있다.
특히 많은 연구결과는 대사 효소를 제어함으로써 항암 효과를 극대화 하고자 하였고, glucose, glutamine, fatty acid 대사과정에 관여하는 대사효소를 타겟으로 하는 약물이 개발되었다. 예를 들어, 암세포가 Aerobic glycolysis에 의존한다는 점에 착안하여 HK2를 억제하는 2-DG와 같은 약물이 개발되었고, 지속적인 Glycolysis 유지에 중요한 LDH를 억제하는 PSTMB, Gossypol 등의 약물이 폐암, 유방암, 대장암 등에서 효과적인 것을 확인하였다. Glutamine 대사를 공략하는 약물 또한 다양하게 제시된 바 있는데, Glutamine transporter 억제제인 GPNA와 glutaminase 억제제인 CB-839, BPTES 등이 TNBC와 같은 악성 암종에서 효과적인 것으로 알려졌다.(27) 뿐만 아니라 지방질 합성에 있어 fatty acid chain을 합성하는 데 관여하는 효소인 Fatty acid synthase (FASN)을 억제하는 약물인 C75나 fasnall 약물 또한 HER2+ 유방암에 효과를 보이는 것으로 나타났다.(28)(그림 1)
흥미롭게도 암 대사와 관련된 최신 연구들은 식이 조절의 중요성을 역설하는데, 암세포가 종양미세환경의 영양소 농도에 크게 영향을 받는다는 점을 고려할 때 음식물의 영양소 조성은 종양미세환경 구성에 중요한 요인으로 생각된다. 따라서 암의 대사적 의존성을 타겟으로 하기 위해 Fasting mimicking diet (FMD)나 간헐적 단식을 처방하는 것은 그 자체로 항암효과가 있을 뿐 아니라, 다양한 항암 요법의 민감성을 높여주는 방식으로 보고되고 있다.(29) 특히 FMD는 HO-1을 억제해 활성산소를 유발하고 전이를 억제하며, 간헐적 단식은 IGF-1 신호전달경로를 억제하여 암의 성장을 막는 것으로 밝혀졌다. 또한 대사 조절을 통해 발생하는 암의 Metabolic platicity를 타겟으로 하기 위해 식이 조절과 대사 항암제를 병용하는 전략도 제시된 바 있다.(30)
3. 결론
본 총설을 통해 암 대사의 전반적인 특징과 이를 타겟으로 하는 4세대 대사항암제 개발에 관하여 논의하였다. 암 대사는 최근 들어 연구가 활발히 진행되는 분야로, 암 대사체는 복잡하고 정교한 네트워크로 구성되어 있기에 이들의 연관관계를 추후 연구해야 할 필요가 있다. 특히 최근 연구들은 암의 대사적 유동성에 집중하여 여러 대사적 보상경로를 동시에 억제하는 방식의 병용요법을 도입하기도 하였으며, 식이 조절을 보조요법(Adjuvant therapy)으로 활용하여 기존 항암제의 효율을 극대화하는 방법 또한 도입되었다. 뿐만 아니라, 향후 암 대사에 대한 연구가 더 진행되면, 개별 환자의 대사체 조성에 맞춰 최적의 효율을 보일 수 있는 약물을 탐색 하는 방식으로 정밀의료 또는 맞춤형 의료를 도입할 수 있을 것으로 생각된다.
1. Warburg O, Wind F and Negelein E (1927) The Metabolism of Tumors in the Body. J Gen Physiol 8, 519-530
2. Lunt SY and Vander Heiden MG (2011) Aerobic glycolysis: meeting the metabolic requirements of cell proliferation. Annu Rev Cell Dev Biol 27, 441-464
3. Wolf E, Lin CY, Eilers M and Levens DL (2015) Taming of the beast: shaping Myc-dependent amplification. Trends Cell Biol 25, 241-248
4. Kruiswijk F, Labuschagne CF and Vousden KH (2015) p53 in survival, death and metabolic health: a lifeguard with a licence to kill. Nat Rev Mol Cell Biol 16, 393-405
5. Osthus RC, Shim H, Kim S et al (2000) Deregulation of glucose transporter 1 and glycolytic gene expression by c-Myc. J Biol Chem 275, 21797-21800
6. Yun J, Rago C, Cheong I et al (2009) Glucose deprivation contributes to the development of KRAS pathway mutations in tumor cells. Science 325, 1555-1559
7. Gottlob K, Majewski N, Kennedy S, Kandel E, Robey RB and Hay N (2001) Inhibition of early apoptotic events by Akt/PKB is dependent on the first committed step of glycolysis and mitochondrial hexokinase. Genes Dev 15, 1406-1418
8. Semenza GL (2003) Targeting HIF-1 for cancer therapy. Nat Rev Cancer 3, 721-732
9. Sun L, Song L, Wan Q et al (2015) cMyc-mediated activation of serine biosynthesis pathway is critical for cancer progression under nutrient deprivation conditions. Cell Res 25, 429-444
10. Wise DR, DeBerardinis RJ, Mancuso A et al (2008) Myc regulates a transcriptional program that stimulates mitochondrial glutaminolysis and leads to glutamine addiction. Proc Natl Acad Sci U S A 105, 18782-18787
11. Perez-Escuredo J, Dadhich RK, Dhup S et al (2016) Lactate promotes glutamine uptake and metabolism in oxidative cancer cells. Cell Cycle 15, 72-83
12. Gao P, Tchernyshyov I, Chang TC et al (2009) c-Myc suppression of miR-23a/b enhances mitochondrial glutaminase expression and glutamine metabolism. Nature 458, 762-765
13. Son J, Lyssiotis CA, Ying H et al (2013) Glutamine supports pancreatic cancer growth through a KRAS-regulated metabolic pathway. Nature 496, 101-105
14. Dong Q, Giorgianni F, Beranova-Giorgianni S et al (2015) Glycogen synthase kinase-3-mediated phosphorylation of serine 73 targets sterol response element binding protein-1c (SREBP-1c) for proteasomal degradation. Biosci Rep 36, e00284
15. Li S, Oh YT, Yue P, Khuri FR and Sun SY (2016) Inhibition of mTOR complex 2 induces GSK3/FBXW7-dependent degradation of sterol regulatory element-binding protein 1 (SREBP1) and suppresses lipogenesis in cancer cells. Oncogene 35, 642-650
16. Potapova IA, El-Maghrabi MR, Doronin SV and Benjamin WB (2000) Phosphorylation of recombinant human ATP:citrate lyase by cAMP-dependent protein kinase abolishes homotropic allosteric regulation of the enzyme by citrate and increases the enzyme activity. Allosteric activation of ATP:citrate lyase by phosphorylated sugars. Biochemistry 39, 1169-1179
17. Bensaad K, Favaro E, Lewis CA et al (2014) Fatty acid uptake and lipid storage induced by HIF-1alpha contribute to cell growth and survival after hypoxia-reoxygenation. Cell Rep 9, 349-365
18. DeNicola GM, Karreth FA, Humpton TJ et al (2011) Oncogene-induced Nrf2 transcription promotes ROS detoxification and tumorigenesis. Nature 475, 106-109
19. Sasaki H, Suzuki A, Shitara M et al (2013) Keap1 mutations in lung cancer patients. Oncol Lett 6, 719-721
20. Barbano R, Muscarella LA, Pasculli B et al (2013) Aberrant Keap1 methylation in breast cancer and association with clinicopathological features. Epigenetics 8, 105-112
21. Enzo E, Santinon G, Pocaterra A et al (2015) Aerobic glycolysis tunes YAP/TAZ transcriptional activity. EMBO J 34, 1349-1370
22. Fang J, Sawa T, Akaike T, Greish K and Maeda H (2004) Enhancement of chemotherapeutic response of tumor cells by a heme oxygenase inhibitor, pegylated zinc protoporphyrin. Int J Cancer 109, 1-8
23. Andrzejewski S, Klimcakova E, Johnson RM et al (2017) PGC-1alpha Promotes Breast Cancer Metastasis and Confers Bioenergetic Flexibility against Metabolic Drugs. Cell Metab 26, 778-787 e775
24. Kreso A and Dick JE (2014) Evolution of the cancer stem cell model. Cell Stem Cell 14, 275-291
25. Zhou Y, Zhou Y, Shingu T et al (2011) Metabolic alterations in highly tumorigenic glioblastoma cells: preference for hypoxia and high dependency on glycolysis. J Biol Chem 286, 32843-32853
26. Viale A, Pettazzoni P, Lyssiotis CA et al (2014) Oncogene ablation-resistant pancreatic cancer cells depend on mitochondrial function. Nature 514, 628-632
27. Gross MI, Demo SD, Dennison JB et al (2014) Antitumor activity of the glutaminase inhibitor CB-839 in triple-negative breast cancer. Mol Cancer Ther 13, 890-901
28. Alwarawrah Y, Hughes P, Loiselle D et al (2016) Fasnall, a Selective FASN Inhibitor, Shows Potent Anti-tumor Activity in the MMTV-Neu Model of HER2(+) Breast Cancer. Cell Chem Biol 23, 678-688
29. Vernieri C, Casola S, Foiani M, Pietrantonio F, de Braud F and Longo V (2016) Targeting Cancer Metabolism: Dietary and Pharmacologic Interventions. Cancer Discov 6, 1315-1333
30. Elgendy M, Ciro M, Hosseini A et al (2019) Combination of Hypoglycemia and Metformin Impairs Tumor Metabolic Plasticity and Growth by Modulating the PP2A-GSK3beta-MCL-1 Axis. Cancer Cell 35, 798-815 e795