
생화학분자생물학회입니다.
Laboratory of Diabetes and Obesity
작성자
관리자작성일자
2017-12-01조회수
779Laboratory of Diabetes and Obesity
오경진
한국생명공학연구원(KRIBB)/대사제어연구센터
[연구실소개]
현대 한국인의 4명 중 1명은 “인슐린 저항성(Insulin Resistance)”과 관련된 대사이상에 노출되어 있다. 2017년 현재 당뇨병을 앓고 있는 환자는 500만 명 이상으로 급증하여, “당뇨” 및 “당뇨 전단계”의 환자가 한국인 10명 중 3명을 차지하고 있다. 한국인의 “제2형 당뇨(Type 2 Diabetes)”의 유발은 특히 “비만(Obesity)”과 밀접한 관련성을 맺고 있으며, 이는 당뇨인구의 3/4이 비만 및 과체중을 나타내는 것으로 미루어 보아 한국인의 당뇨의 주요 원인이 비만임을 알 수 있다.
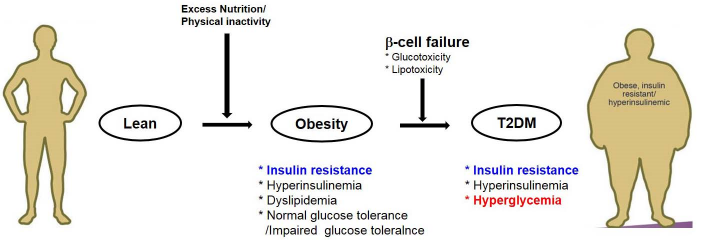
그림1. 비만 및 제 2형 당뇨의 특징
본 연구실에서는 제2형 당뇨와 비만에서 나타나는 인슐린 저항성(Insulin Resistance)의 유발 기전 및 제어에 관심을 갖고 연구를 진행하고 있다. 특히, 체내 당대사(Glucose Metabolism) 및 지질대사(Lipid Metabolism)와 인슐린 신호전달 체계의 변화, 그리고 이로 인한 체내 대사 체계의 변화에 초점을 두고 있다. 때문에 비만 및 당뇨 상황, 금식, 소포체 스트레스(ER-Stress) 와 같은 다양한 대사 환경의 변화에서 뚜렷한 변화를 내는 요소를 후보군으로 선정하여, 당뇨 및 비만에서 나타나는 에너지 대사체계의 불균형을 개선할 수 있는 타깃을 찾고 그 기능 및 신호전달 체계를 찾는 규명하는 것이 본 연구의 목적이다.
본 연구실에서는 식이섭취에 따른 제 2형 당뇨 및 비만 마우스 모델을 구축하여 실험을 진행하고 있으며, FLP-FRT Recombination System과 Cre-LoxP Recombination System을 이용하여 전신 및 조직특이적으로 타깃 유전자의 결손 마우스 모델을 제작하여 인슐린 감수성 장기들간의 대사적 네트워크를 총체적으로 해석하고자 하며, 추가적으로 아데노바이러스를 통한 Gene Delivery System을 이용하여 연구를 진행하고 있다.
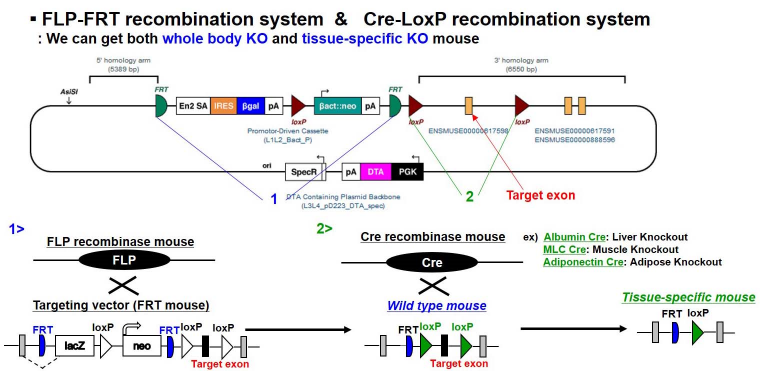
그림2. 전신 및 조직특이적 결손 마우스 모델 제작 방법
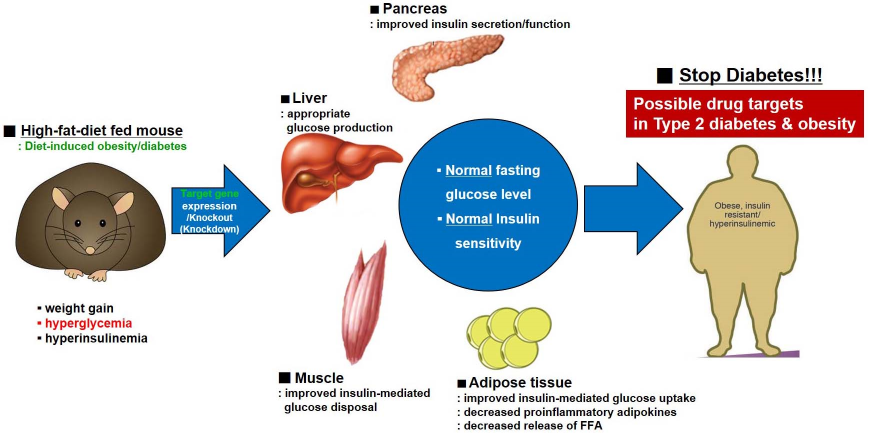
그림3. 당뇨/비만에서 나타나는 에너지 대사의 불균형을 개선할 수 있는 타깃 발굴을 위한 전략
[연구내용]
제2형 당뇨(Type 2 Diabete) 및 비만(Obesity)은 간, 근육, 지방과 같은 말초조직(Peripheral Tissue)의 “인슐린저항성(Insulin Resistance)”을 원인으로 유발된다. 대표적인 인슐린 감수성 조직인 간(Liver), 근육(Skeletal Muscle), 지방(Adipose Tissue)에서 손상된 인슐린 기작은 간에서의 당생성 증가, 근육에서 당 흡수의 억제, 지방의 축적을 유도하게 되고, 인슐린저항성을 근간으로 제2형 당뇨의 특징인 고혈당(Hyperglycemia)을 유발하게 된다.
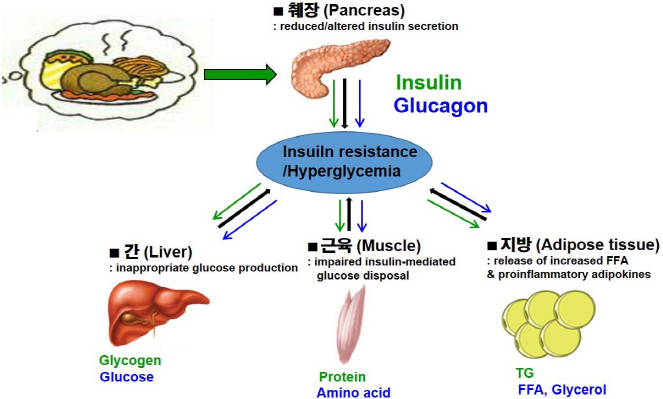
그림4. 인슐린저항성 및 고혈당 상황에서의 인슐린 감수성 조직 내 대사적 변화
1. 혈당조절 특이적 제2형 당뇨 치료제의 새로운 타깃 발굴
본 연구실에서는 유전자 후보군들에 대한 당대사의 주요 기관인 간, 근육, 지방 특이적 결손 마우스를 제작하여 혈당조절에 특이적으로 작용할 수 있는 제2형 당뇨의 치료의 신규 타깃으로서 후보군들을 검증하고 있다.
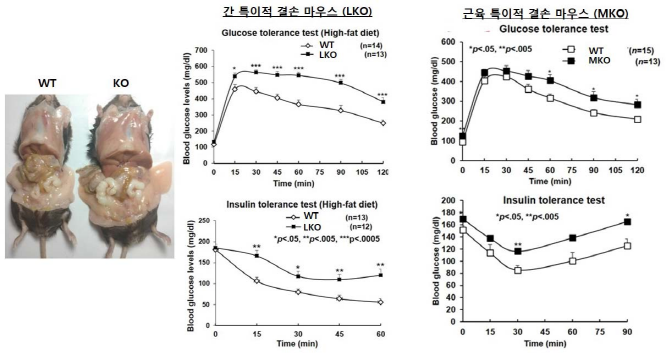
그림5. 간과 근육 특이적 후보군 결손 마우스 내 당대사표현형 및 인슐린 감수성 측정
2. 간에서의 에너지 대사 연구
비만 및 당뇨, 금식, 소포체 스트레스(ER-Stress) 와 같은 다양한 대사 환경의 변화와 관련된 후보군들 선정하고, 일차 간세포주 및 마우스모델에서 기능연구를 진행하고 있다. 간 특이적 마우스 및 아데노바이러스를 이용하여 인슐린 신호전달 체계 및 당/지질대사에 미치는 영향에 대한 연구를 진행 중에 있다.
3. 근육에서의 에너지 대사연구
노화에 따른 중요한 체구성 성분의 변화인 근소실은 노인성비만을 유도하며, 당뇨, 암, 심혈관질환을 비롯한 노인성 질환의 주요 원인이다. 본 실험실에서는 노화에 따른 근손실과 비만과의 관련성을 규명하기 위하여 유전자 변형 마우스 사용하여 연구를 진행 중에 있다.
[연구책임자]

오경진 (KRIBB: 선임연구원/UST: 부교수)
주소: 대전광역시 유성구 과학로 125, 한국생명공학연구원 연구동 3124호
전화: 042-879-8265
팩스: 042-860-4149
이메일: kjoh80@kribb.re.kr (kyoungjoh@gmail.com)
[연구진구성]
박사과정: 박안나 (KAIST 학연과정), 이다솜 (KAIST 학연과정),
통합과정: 김현미 (UST/박사과정) 안태현 (UST/석사과정)
석사과정: 이정은 (UST)

1. Byun, S.K., An, T.H., Son, M.J., Lee, D.S., Kang, H.S., Lee, E.W., Han, B.S., Kim, W.K., Bae, K.H., Oh, K.J., Lee, S.C. (2017) HDAC11 Inhibits Myoblast Differentiation through Repression of MyoD-Dependent Transcription. Mol Cells 40, 667-676.
2. Oh, K.J., Lee, D.S., Kim, W.K., Han, B.S., Lee, S.C., Bae, K.H. (2016) Metabolic Adaptation in Obesity and Type II Diabetes: Myokines, Adipokines and Hepatokines. Int J Mol Sci 18. pii: E8. .
3. Lee, G.H., Oh, K.J., Kim, H.R., Han, H.S., Lee, H.Y., Park, K.G., Nam, K.H., Koo, S.H., Chae, H.J. (2016) Effect of BI-1 on insulin resistance through regulation of CYP2E1. Sci Rep 6, 32229.
4. Lee, D.S., Choi, H., Han, B.S., Kim, W.K., Lee, S.C., Oh, K.J., Bae, K.H. (2016) c-Jun regulates adipocyte differentiation via the KLF15-mediated mode. Biochem Biophys Res Commun 469, 552-558.
5. Oh, K.J., Han, H.S., Kim, M.J., Koo, S.H. (2013) CREB and FoxO1: two transcription factors for the regulation of hepatic gluconeogenesis. BMB Rep 46, 567-574.
6. Oh, K.J., Han, H.S., Kim, M.J., Koo, S.H. (2013) Transcriptional regulators of hepatic gluconeogenesis. Arch Pham Res 36, 189-200.
7. Oh, K.J., Park, J., Kim, S.S., Oh, H., Choi, C.S., Koo, S.H. (2012) TCF7L2 modulates glucose homeostasis by regulating CREB- and FoxO1-dependent transcriptional pathway in the liver. PLoS Genet 8, e1002986.
8. Choi, D., Oh, K.J., Han, H.S., Yoon, Y.S., Jung, C.Y., Kim, S.T., Koo, S.H. (2012) Protein arginine methyltransferase-1 regulates hepatic glucose production in a FoxO1 dependent manner. Hepatology 56, 1546-1556.
9. Oh, K.J., Park, J., Lee, S.Y., Hwang, I., Kim, J.B., Park, T.S., Lee, H.J., Koo, S.H. (2011) Atypical antipsychotic drugs perturb AMPK-dependent regulation of hepatic lipid metabolism. Am J Physiol Endocrinol Metab 300, E624-E632.
10. Ryu, D., Oh, K.J., Jo, H.Y., Hedrick, S., Kim, Y.N., Hwang, Y.J., Park, T.S., Han, J.S., Choi, C.S., Montminy, M., Koo, S.H. (2009) TORC2 regulates hepatic insulin signaling via a mammalian phosphatidic acid phosphatase, LIPIN1. Cell Metab 9, 240-251.