
생화학분자생물학회입니다.
장내 공생미생물과 그 대사체 연구
작성자
관리자작성일자
2017-12-01조회수
1391장내 공생미생물과 그 대사체 연구

류동렬
부산대학교 한의학전문대학원
1. 서론
우리 몸에서 공생하는 미생물 군집, 즉, 휴먼 마이크로바이오타(Human Microbiota)에 대한 연구가 최근 많은 주목을 받고 있다. 휴먼 마이크로바이오타는 출산 시 어머니에게서 전달받는 것을 시작으로 우리 몸의 소화기, 피부, 구강 등에 정착하여 일생 동안 공생의 관계를 유지하는 것으로 알려져 있다. 최근에 만난 한 연구자는 자신의 연구를 발표하면서 내과학(Internal Medicine) 교과서를 다시 집필해야 한다고 주장하기도 했다. 그 연구자는 일반적으로 공생하는 미생물이 없다고 알려진 기도(Airway)에 존재(공생)하는 마이크로바이오타를 연구하는 학자이다. 즉, 기도에도 공생하는 마이크로바이오타가 존재하며, 존재를 부정하는 기존의 교과서를 수정해야 한다고 주장한 것이다. 소위 유전공학이라는 기술이 태동하면서 한때 붐의 중심에 있었던 미생물이 차세대 염기서열 분석(Next Generation Sequencing; NGS)을 대표로 하는 다양한 OMICS 기술이 발전하면서 ‘마이크로바이오타’라는 이름으로 다시금 가장 뜨거운 연구 분야가 되었다.
먼저 용어에 대한 정의를 간략히 살펴보자. 마이크로바이오타는 인간을 포함하는 다세포생물에 존재하는 공생성(Symbiotic) 또는 병원성(Pathogenic) 미생물의 군집을 말한다. 이 중에서도 편리공생(Commensalism) 관계에 있는 미생물 군집을 코멘살(Commensals)이라고 부르기도 한다. 마이크로바이오타와 유사하게 사용되는 단어로는 마이크로플로라(Microflora)가 있다. 그럼 마이크로바이옴(Microbiome)이란 무엇인가? 마이크로바이옴은 마이크로바이오타로 통칭되는 미생물 군집 내의 전체 유전자, 즉, 유전체(Genome)를 의미한다. 마이크로바이오타는 개인의 생물학적 특징(인종, 유전 배경, 연령 등)과 환경적 특징(식습관, 지리학적 위치 등)에 따라 차이를 보일 수 있으며, 이는 차세대염기서열 분석 방식으로 마이크로바이옴을 평가함으로 알 수 있다. 다르게 말하자면, 미생물의 16S ribosomal RNA(rRNA) 유전자를 분석하는 방식으로는 마이크로바이오타를 분석할 수 있어도, 마이크로바이옴은 분석할 수 없다는 것이다.
NCBI의 PubMed에서 “(microbiota[Title/Abstract] OR microbiome[Title/Abstract])”를 키워드로, 마이크로바이오타 또는 마이크로바이옴이라는 단어를 논문의 제목 또는 초록에 포함하는 논문을 조사해보면, 2017년 10월 말 현재 약 3천1백여 편의 논문이 검색 된다 (그림 1의 노란색 막대그래프). 또한 동일 조건으로 임상시험(Clinical Trial) 관련 논문만 검색해보면 대략 1천 건이 된다. WIPO Patentscope(https://patentscope.wipo.int/)에서 동일 방식으로 검색한 결과 (그림 1의 파란색 실선)에서도 마이크로바이오타 관련 특허가 급격하게 증가하고 있음을 알 수 있다. 폭발적으로 발표되는 이들 논문은 마이크로바이오타가 우리 몸에 얼마나 큰 영향을 줄 수 있는지 보여주는 근거라고 말할 수도 있겠다. 또한 이는 우리 몸과 마이크로바이오타 사이의 신호전달 체계가 존재하며, 이를 매개하는 분자 등이 존재할 수 있음을 강력하게 시사한다.
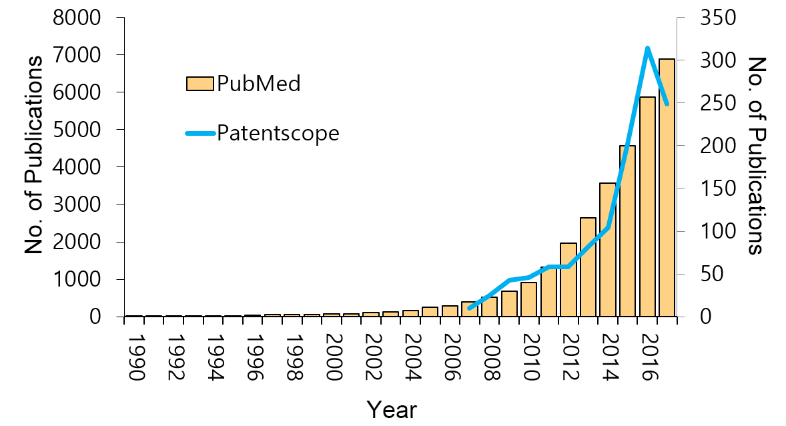
그림 1. PubMed 및 PatentScope에서 검색된 마이크로바이오타 관련 논문 및 특허 동향
본 리뷰에서는 다양한 휴먼 마이크로바이오타 중에서 가장 많은 연구가 이뤄진 장내 마이크로바이오타 관련 연구를 개괄적으로 먼저 살펴보고, 이어서 호스트와 마이크로바이오타 사이의 신호 전달자(Signal Messenger)로 작용할 가능성이 높은 마이크로바이오타 유래 대사체(Metabolite)에 대해서 살펴보자.
2. 본론
2-1. 장 마이크로바이오타의 분류
약 100조(1014)개의 마이크로바이오타와 10진(1015)개의 바이러스가 인체에 존재한다고 알려져 있다 (1). 이는 인체에 존재하는 전체 세포 수의 10배 이상이며, 마이크로바이오타가 보유하는 유전자의 수 역시 인간 유전체의 수백 배 존재한다고 한다. 휴먼 마이크로바이오타의 무게는 약 0.5~1kg으로 알려져 있기도 하지만, 최근 연구에서는 몸무게 70 kg의 남성의 경우 약 0.2kg(체중의 0.3%) 정도인 것으로 평가되었다 (2). 기존에는 위장관에 대략 8개의 박테리아 문(Phylum)이 존재하는 것으로 알려져 있었다. 하지만, 인간의 분변 샘플을 이용한 16S rRNA 유전자를 분석한 최근 연구에서는 사람의 장 마이크로바이오타에서 12개의 다른 문(Phylum)으로 분류될 수 있는 총 2,172 종(Species)이 확인되었으며, 이 중 93.5%가 Proteobacteria, Firmicutes, Actinobacteria, Bacteroidetes로 구성된다고 한다. 이 중 386개의 종(Species)은 일반적으로 구강과 위장관의 점막에 위치하는 것으로 알려진 혐기성(Anaerobic) 박테리아로 확인되었다 (3).
장 마이크로바이오타 연구에서 가장 중요한 용어를 들라면 그중 하나가 엔테로타입(Eneterotype)이다. 엔테로타입 개념은 2011년도 발표된 Peer Bork 그룹의 논문에 잘 정의되어 있다 (4). 이 논문에 따르면 22명의 유럽인(프랑스, 이태리, 스페인, 덴마크인), 13명의 일본인과 4명의 미국인으로 구성된 39명의 데이터를 분석(Principle Component Assay; PCA)한 결과, Bacteroides(엔테로타입 1), Prevotella(엔테로타입 2), Ruminococcus(엔테로타입 3)로 군집을 이뤄 분리되는 엔테로타입이 존재하는 것을 발견하였다. 같은 해 발표된 James D. Lewis 그룹의 논문에서도 엔테로타입의 존재를 확인하였으며, 특히 장기간 다이어트와 2개의 엔테로타입이 상관관계를 가지는 것을 보고하였다 (5). Bacteroides은 단백질과 동물성 지방, Prevotella은 탄수화물 섭취와 상관관계를 가지고 있었다.
일부 최근 연구에서는 엔테로타입은 구분이 항상 명확한 것은 아니라고 보고하였다. 노년층의 식습관과 건강 상태와 장 마이크로바이오타를 연구한 Paul W. O’Toole 그룹의 연구에서는 클러스터링 방식에 따라 엔테로타입의 패턴이 전혀 다른 결과가 나올 수 있음을 보였다 (6). 이 연구에서는 젊은 연령층(n = 13)에서 Rumniococcus가 가장 많이 존재하는 것으로 확인되었고, 노년층(n = 178)에서는 여러 조건에 상관없이 Rumniococcus가 감소한 것을 확인하였다. 특히, 노년층에서는 Rehabilitation(재활)과 Long-Stay(장기 요양) 그룹에서 Community(상대적으로 건강하여 지역에 거주하는) 그룹에 비해, Escherichia/ Shigella 종이 유의하게 증가된 것을 발견하였다. 또한, 엔테로타입 분류 방식으로는 보이지 않지만, Community(상대적으로 건강하여 지역에 거주하는) 그룹과 Long-Stay(장기 요양) 그룹에서 명확하게 마이크로바이오타의 종의 차이가 있음을 관찰하여 보고하였다. 비록 이 사실로부터 건강한 노인과 장기 요양으로 노쇠한 노인의 장내미생물이 다르다는 것을 이해할 수 있으나, 엔테로타입은 절대적 기준이 되지 않을 수 있음을 이해하여야 한다.
2-2. 장 마이크로바이오타의 기능
앞서 간략히 살펴본 것처럼 장 마이크로바이오타는 엔테로타입의 형식으로 군집을 이루고 있을 개연성이 높으며, 그 군집, 즉 엔테로타입의 패턴은 식습관을 포함하는 환경적 배경, 유전적 배경, 질환, 연령 등에 의해서 변화될 수 있다. 이를 다르게 표현하면, 장 마이크로바이오타가 호스트의 생리 및 병리 현상에 직간접으로 영향을 주고받을 수 있다는 것이다. 오랜 진화의 과정을 통해서 확립된 공생 과정에서 호스트와 마이크로바이오타의 생물학적 상호 결합은 어쩌면 당연하고 필연적인 것이라고 생각해볼 수도 있을 것이다. 따라서 마이크로바이오타가 호스트의 생리학적 변화, 항상성 유지에 영향을 준다는 연구결과는 그렇게 놀라운 것이 아니며, 반대로 호스트의 유전적 배경에 의해 차이를 가질 수 있는 위장관의 환경이 마이크로바이오타 커뮤니티 형성에 일종의 Niche로 작용할 수 있을 것이다.
유아는 멸균된 또는 매우 낮은 수준의 장 마이크로바이오타를 가지고 태어나는 것으로 알려져 있다. 출산 및 수유 과정 등을 통해서 장 마이크로바이오타에 노출이 되며, 일생 동안 이어질 공생을 시작한다. 위장관에 정착한 마이크로바이오타는 에너지대사, 면역, 장 보호 등의 다양한 기능을 하는 것이 알려져 있다 (7).
2-3. 에너지대사에서 기능
장 마이크로바이오타는 인간이 분해(소화)하지 못하는 식이섬유와 같은 탄수화물을 작은 대사체(Small Metabolite) 형태로 전환하여 제공한다 (7, 8). Enterobacteria(Pyruvate-Acetyl-CoA로부터 Acetate를 생산함), Bifidobacterium(Pyruvate-Acetyl-CoA로부터 Acetate를 생산함), Bacteroides(Succinate로부터 Propionate를 생산함), 및 Faecalibacterium(Acetyl-CoA로부터 Butyrate를 생산함)와 같은 미생물이 단쇄지방산(Short Chain Fatty Acid; SCFA)을 생산하는 것이 알려져 있다 (8). 생산된 SCFA는 에너지원으로 직접 이용되기도 하며, G-Protein-Coupled-Receptors(GPCR)에 직접 결합해 활성화하기도 하여 에너지 대사에 관여하는 것이 알려져 있다. 일부 SCFA(Butyrate)는 Protein Deacetylase의 Inhibitor로서 작용하는 것으로도 알려져 있다. 이는 장 마이크로바이오타가 호스트의 세포에서 후성유전학적 변형(Epigenetic Modifications)에 관여함으로 유전자 발현에 영향을 줄 수도 있음을 유추하게 한다.
SCFA 중 Propionate와 Acetate는 GPR43과 결합하여 GLP-1과 PYY 분비를 촉진하고, 에너지 대사와 인슐린 민감성을 증가를 유도하며, 전구지방세포(Preadipocyte) 분화에도 관여한다. Butryate와 Propionate는 GPR41에 결합하여, 에너지 소비, 미토콘드라이 호흡률이 증가되게 유도하며, 음식 섭취량을 감소하게 한다. Butryate는 GRP199A에 결합하는 것도 알려져 있으며, 이로부터 장 염증 반응을 낮추고, 암의 생성을 낮출 수 있는 것이 보고되었다.
또한, 장내 미생물과 이들에 의해서 생산된 작은 대사체(Small Metabolites)는 지방세포에서 Lipoprotein Lipase 활성을 억제함으로써 지질대사(Lipid Metabolism)를 개선할 수 있는 것이 알려져 있다 (7). 일부 Bacteroides는 항당뇨, 항동맥경화, 항비만 효과를 가지는 Conjugated Linoleic Acid(CLA)를 합성한다. 이들 연구는 최근에 405명 중국인을 대상으로 분석한 연구에서 장 마이크로바이오타가 심혈관계 질환과 연관되어 있음이 보여준 연구와 맥을 같이한다 (9). 대부분의 비타민 B(Biotin, Cobalamin, Folates, Nicotinic Acid, Panthotenic Acid, Pyridoxine, Riboflavin, Thiamine)와 K의 합성도 장 마이크로바이오타의 잘 알려진 에너지대사와 관련된 기능이다 (3, 7, 10). 지질대사와 에너지대사 조절에 기여를 하는 것으로 알려진 담즙산(Bile Acid) 대사에서 장 마이크로바이오타가 관여하는 것도 알려져 있다.
앞서 언급된 연구들은 장 마이크로바이오타가 우리 몸의 에너지대사에 핵심적인 역할을 할 가능성을 시사하고 있다. 에너지대사 연구 분야에서 바이크로바이오타 연구 분야만큼 뜨거운 분야가 비떨림열생산(Non-Shivering Thermogenesis)에 관한 분야이다. 일명, 브라우닝(Browning)으로 알려진 이 현상에도 장 마이크로바이오타가 관여할 가능성이 있음을 보여주는 연구가 속속 발표되고 있다 (11-14). 장 마이크로바이오타가 담즙산 대사에 관여하고, 담즙산은 에너지 대사율을 증가시키는 것이 알려져 있기 때문에 장 마이크로바이오타가 에너지 대사에 관여하는 것은 어쩌면 이미 예견된 것일 수도 있다 (15). 이 연구의 다른 의미는 저온 노출이 장내 미생물 군집의 변화를 유도할 수도 있으며, 그와 같은 장내 미생물 군집의 변화가 호스트의 저온 환경에 대한 적응에 기여한다는 것을 증명한 것이다. 다시 말해, 장 마이크로바이오타에서 우리 몸으로 영향을 줄 뿐만 아니라 호스트도 장 마이크로바이오타의 생태를 변화되게 함으로 군집의 구성에 영향을 줄 수 있다는 것이다. 즉, 호스트가 장 마이크로바이오타의 Niche를 다이내믹하게 조절할 수도 있다는 의미이다. 호스트에 대한 장 마이크로바이오타의 역할의 연구만큼 호스트의 장 마이크로바이오타에 대한 영향을 밝히는 연구도 필요하다.
2-4. 장내 면역조절 기능
장 마이크로바이오타는 다양한 형식으로 위장관계 면역체계에 기여를 하는 것이 알려져 있다. 그중 하나가 외부 침입자들에 대한 방어장벽(Barrier)으로써 역할이 가능하게 위장관의 구조와 기능 유지에 기여를 하는 것이다. 예를 들면, 장 상피 융모(Epithelial Villus)의 Desmosome의 구조적 유지에 필요한 Small Proline-Rich Protein 2A(Sprr2A)의 발현 증가를 Bacteroides thetaiotaomicron이 유도한다는 보고가 있다 (16). Lactobacillus rhamnosus의 경우 p40과 p75로 명명된 단백질을 합성 및 분비하여 Epithelial Growth Factor Receptor(EGFR)와 Protein Kinase C(PKC) 의존적 방식으로 Cytokine에 의한 세포사멸(Apoptosis)을 막을 수 있는 것이 알려져 있다 (17). 장 마이크로바이오타가 위장관 구조 형성에 역할을 할 수 있다는 간접적인 증거들은 무균(Germ-Free) 동물을 이용한 실험에서 확인되었다. 예를 들면, 무균동물 모델의 장 점막 표면(Mucosal Surface)의 두께가 얇고 (18), 융모의 숫자는 감소되어 있으며 (19), 연동운동이 감소 (20) 되었다는 보고 등이 있다. 또한, 장 마이크로바이오타는 Bacteriocin 등과 같은 항미생물 단백질(Antimicrobial Peptide)을 직접 생산하거나, Cathelicidin, C-type Lectin, Pro-Defensing 등과 같은 물질을 호스트의 Panthe 세포로 하여금 만들게 하여, 병원성 미생물의 침입과 증식을 제어한다 (7, 21).
장 마이크로바이오타는 내재성(Innate)과 적응성(Adaptive) 면역체계 모두와 긴밀하게 이어져 있다. 체내 면역계는 장 미생물에 대한 내성(Tolerance)도 가지고 있어야 하며, 장 미생물의 과증식도 억제해야 한다. 따라서 두 집단 사이의 밀접한 교류는 필수적이다. 실제로 앞서 에너지대사 부분에서 언급한 SCFA에 직접 Interaction하는 GPR41, GPR43, GPR109A 등은 Mast, Eosinophil, Neutrophil, Foxp3+ T Regulatory(Treg) 세포 등에 발현하여, 장 미생물로부터 유래하는 SCFA에 의해서 면역반응이 조절 받는 것에 결정적인 역할을 하는 것이 알려져 있다 (7, 8).
2-5. 장 마이크로바이오타와 관련 질환
여러 질환과 장 마이크로바이오타의 관계는 앞서 간략히 살펴본 장 마이크로바이오타의 기능으로부터 쉽게 추측할 수 있다. 장 마이크로바이오타가 거주하는 위장관 관련 질환, 대사질환, 자가면역질환을 비롯한 면역계 질환 등이 대표적이면 최신 연구에 의하면 파킨슨병과 같은 퇴행성 신경 질환과 자폐증 증상 등과도 관계가 있는 것으로 밝혀지고 있다 (7, 22, 23).
2-6. 장관련 질환
과민성 대장 증후군(Irritable Bowel Syndrome)의 병인학적 요인은 다양하지만, 최근 연구는 장 마이크로바이오타 군집의 변화와 질환에서 보이는 낮은 수준의 염증반응과 관련이 있음이 보고되었다 (22). 비록 발표된 논문들 사이에서 변화되었다고 특정된 장 마이크로바이오타 군집이 일치하지 않았지만, 대부분의 연구에서 변화된 미생물은 발견되었다. 과민성대장증후군의 다양한 병인을 고려한다면, 연구별 변화된 군집이나 미생물의 차이도 설명 가능하다. 다시 말해 보고된 연구마다 병인 다를 수 있기 때문에 변화된 장 마이크로바이오타의 군집 또는 미생물도 다르다고 생각할 수 있다.
염증성 장질환(Inflammatory Bowel Disease; IBD)과 장 마이크로바이오타의 관계를 보여주는 연구도 매우 많다. 인과론적 관점에서 장 마이크로바이오타 군집의 변화가 원인인지 여전히 불분명한 경우도 있지만, 염증성 장질환에서 장 마이크로바이오타의 변화를 많은 경우 볼 수 있다. 흥미로운 것은 염증성 장질환에서 장 마이크로바이오타 군집의 다양성이 감소했다는 보고가 있다는 것이다 (22). 이는 앞서 설명한 장 마이크로바이오타가 위장관 구조 형성에 기여한다는 점을 고려해본다면, 확인되지 않은 1차적 이유(감염, 유전적 요인 등)로 장 마이크로바이오타의 다양성이 감소되고 이로부터 위장관 구조 형성에 문제가 생김으로 염증반응이 유발될 가능성을 고려해볼 수 있다.
2-7. 비만 및 대사질환
장 마이크로바이오타와 비만 및 대사질환에 관련된 연구도 폭발적으로 증가하고 있는 추세이다. 앞서 설명했던 SCFA에 의한 대사율 조절이나, 장 마이크로바이오타에 의한 2차 담즙산의 생산, 비떨림열생산(Non-Shivering Thermogenesis)과 장 마이크로바이타의 상관관계 등의 연구에서 이미 장 마이크로바이오타가 이들 질환에 관여할 수 있음을 유추해 볼 수 있다. Jeffrey I. Gordon 그룹이 보고한 바에 따르면, 장 마이크로바이오타 군집은 정상(Lean) 생쥐와 비만한 ob/ob 생쥐에서 차이가 있다. 특히, 비만한 ob/ob 생쥐에서 Bacteroidetes가 약 50% 감소하였고, Firmicutes가 약 25% 증가했다고 한다 (24). 사람에서도 유사한 변화가 관찰·보고되었다 (25). 이는 Bacteroidetes와 Firmicutes의 비율이 비만과 중요한 연관성이 있고, 비만의 척도가 될 수도 있음을 나타낸다. 하지만, 사람의 분변을 대상으로 한 실험에서 위와 같은 변화가 공통적으로 관찰되지 않았다. 따라서, 신체적 요인(비만도, 유전적 배경 등)뿐만 아니라 환경적 요인(거주지, 식습관 등) 등의 다양한 변수를 고려하는 대규모 연구가 필요한 상황이다.
제2형 당뇨병의 경우에도 비록 인과관계(관찰된 장 마이크로바이오타가 1차 또는 2차 병인일 수 있는가?)는 명확하지 않지만, 장 마이크로바이오타의 변화는 관찰 보고되었다. 제2형 당뇨병 환자의 분변 마이크로바이오타에서 Firmicutes와 Clostridia는 감소를 보였고, Bacteroidetes와 Betaproteobacteria는 증가되어있음이 관찰되었다 (22). 또 다른 연구에서는 제2형 당뇨병 환자에서 Butyrate-Producing Bacteria 군집이 감소되어있음을 보고했다. 이는 장 마이크로바이오타로부터 만들어지는 SCFA가 에너지대사 및 관련 질환에서 중요한 역할을 할 수 있음을 시사하고 있다.
장 마이크로바이오타는 이 외에도 자가면역질환(제1형 당뇨병, 류마티스성 관절염 등), 퇴행성 신경 질환, 임신성 질환에도 관여하거나 상관관계를 보이는 것이 지속적으로 보고되고 있다. 장 마이크로바이오타가 1차 병인이 아닐 가능성이 높아 보이는 질환에서도 이와 같은 상관관계를 보이는 것은 호스트와 장 마이크로바이오타 사이의 상호 신호전달 체계가 존재함을 보여주는 간접적인 증거라고 할 수 있을 것이다. 호스트와 장 마이크로바이오타 사이의 신호전달에 대한 연구의 필요성을 보여주는 대목이라고도 할 수 있다.
2-8. 장 마이크로바이오타 유래 대사체
지난 20여 년간 폴리페놀을 대표로 많은 천연물이 다양한 질환의 예방 및 치료, 건강한 삶을 위한 보조제, 항노화 물질로 주목받아왔고, 수백여 편의 논문으로 그 효과가 증명되었다. 그럼에도, 임상실험에서 의미 있는 성공을 거두지 못하고 있다. 이와 같은 전임상과 임상 연구 사이의 간극은 많은 학자들을 천연물 신약 분야에 대하여 비관적 또는 회의적이게 만들었다. 하지만, 마이크로바이오타 연구의 활성으로 그 간극을 채울 수 있는 답을 찾을 수 있을지도 모르겠다. 최근 연구에 따르면 많은 식품 유래 천연 물질이 장 마이크로바이오타에 의해서 더욱 단순한 형태의 화합물로 분해된다고 한다 (26-28).
|
표 1. 장 마이크로바이토 유래 대사물질 (26) | |
|
분류 |
대사체 |
|
Short chain fatty acids and Fermentation products |
Acetate, Butyrate, Proprionate, Lactate, Succinate |
|
Amino acid metabolites |
γ-Aminobutyric acid, α-Aminobutyric acid, 3-Aminoisobutyric acid, Tryptamine, Phenyllactic acid, Phenethylamine, Indole |
|
Bile Acids metabolites |
Deoxycholic acid, Lithocholic acid, ω-Muricholic acid, Murideoxycholic acid, Ursodeoxycholic acid, Staphyloxanthin |
|
Polyamines |
Serpidine, Spermine, Putrescine, Aminopropylcadaverine, 1,3-Diaminopropane |
|
Polyphenol products |
Urolithins, Equol, Enterolactone, O-Desmethylangolensin |
|
Glycolipids/Lipids |
Mycolic acid, Corynomycolic Acid, Conjugated linolenic acids, α-Galactosylceramide |
|
Vitamins |
Biotin, Cobalamin, Folates, Nicotinic Acid, Panthotenic Acid, Pyridoxine, Riboflavin, Thiamine, Menaquinones |
여전히 마이크로바이오타 연구에는 차세대염기서열 분석을 이용한 연구가 주를 이루고 있지만, 마이크로바이오타 연구의 다른 축으로 질량분광법(Mass Spectrometry)과 전산 생물학(Computational Biology)이 도입되면서 장 마이크로바이오타에 의해서 생산되는 식이 천연물에서 유래된 대사산물의 동정이 진행되어왔다 (표 1, 26). 하지만, 이와 같이 동정된 대사산물과 마이크로바이오타와가 연관성을 가지는 것으로 알려진 비만, 당뇨병, 지방간, 암, 고혈압, 퇴행성 신경 질환, 자폐증, 자가면역질환 등과 같은 질환과의 상관관계를 보는 연구는 상대적으로 미진하다. 다시 말해, 정상군과 특정 환자군의 분변 등을 이용한 군유전체학(Metagenomics) 연구에 환자의 혈청과 분변 추출물을 이용한 질량분석법을 적용한 대사체(Metabolomics) 연구를 결합하여, 질환의 증상 및 마이크로바이오타 엔테로타입(또는 특정 미생물)과 상관관계를 보이는 대사체를 동정한다면 새로운 질환의 바이오마커, 질환을 매개하는 병인, 질환을 치료할 수 있는 약물로서 등의 다양한 가능성을 가질 수 있을 것으로 믿어진다.
예를 들면, 최근에 호스트의 세포에서 오토퍼지(Autophagy) 및 미토퍼지(Mitophagy)를 유도한다고 알려진 Urolithins이라는 장 마이크로바이오타 유래 물질이 있다 (29). Urolithin은 Ellagitannins, Punicalagins, 및 Roburins 등과 같은 폴리페놀로부터 장 마이크로바이오타에 의해서 생성되는 천연 물질이다. Johan Auwerx 그룹의 보고에 따르면, 식이로 공급된 Urolithin A(UA)가 선충(C. elegans)에서는 수명을 약 50% 연장하고, 늙은 설치류 모델에서 근 기능(Muscle Performance)을 개선하며, 이는 세포 내에서 오토퍼지 및 미토퍼지를 증가하였기 때문이라고 설명하고 있다 (29). Urolithin은 현재 임상 1상(NCT02655393; https://clinicaltrials.gov)이 끝났고 임상 2상이 진행 중인 것으로 알려져 있으며, 노령층의 근육강화를 위한 보조제를 목표로 하고 있다고 한다. 다른 예로는 콩에 풍부한 Isoflavone인 Daidzein으로부터 생산되는 Isoflavandiol 중 하나로 알려진 Equol이다. 이 역시 장 마이크로바이오타에 의해서 생산되는 것으로 알려져 있으며, 항산화제와 암에서의 기능 등 다양한 연구가 보고되었다 (30).
기억할만한 사실은 Urolithin과 Equol 등과 같은 장 마이크로바이오타 유래 대사물질이 모든 사람에게서 동일하게 만들어지는 것이 아니라는 것이다. 이는 연구된 질환에서 장 마이크로바이옴이 변화되어 있는 것과 일치할 개연성을 가지는 것이다. 장 마이크로바이오타 연구는 오믹스(OMICS) 기술의 발전으로 새로운 바람을 맞이하고 있다. 이 바람을 기존의 알려진 여러 천연물 신약에 적용한다면, 새로운 형태의 신약을 확보할 가능성이 높을 것으로 기대된다.
3. 결론
다중오믹스(Multi-OMICS)로 대표되는 현대 생물학의 실험 도구의 발전으로 말미암아 지난 10여 년 동안 장 마이크로바이오타 연구 분야는 새로운 전기를 맞이하였다. 그 과정에 등장한 수많은 연구는 호스트보다 더 많은 양의 세포와 유전체로 구성된 마이크로바이오타가 우리 몸의 주인이라는 우스개 이야기도 있을 만큼 우리 몸과 마이크로바이토의 관계를 다시금 정의하고 있다. 앞서 언급된 것처럼 공생관계의 마이크로바이오타가 우리 몸에서 일어나는 많은 생리적 현상에 직접 또는 간접으로 작용할 수 있으며, 이것의 붕괴가 질병의 병인에 깊숙하게 이어져 있음을 알고 있다. 이는 호스트와 장 마이크로바이오타의 다이내믹한 신호전달 체계의 존재를 시사하는 것이기도 하다. 하지만, 장 마이크로바이오타 연구는 많은 경우 상관관계만을 보여주는 경우가 대부분이었으며, 다이내믹한 신호전달 체계를 매개하는 분자(장 마이크로바이오타 유래 대사물, 펩타이드 등)에 대한 연구는 여전히 부족하다. 생리 및 병리 현상에서 변화하거나 작용할 것으로 추정되는 마이크로바이오타 유래 대사체의 동정은 이미 많은 학자들이 주장하는 것처럼 잊혀졌던 천연물로 새로운 형태의 신약의 가능성을 가져올 것으로 믿어진다. 장담컨대, 장 마이크로바이오타 유래 대사체 연구가 천연물 신약 연구 및 개발에 새로운 전기를 가져올 것이다.
참고문헌
1. Clemente, J. C., Ursell, L. K., Parfrey, L. W. and Knight, R. (2012) The impact of the gut microbiota on human health: an integrative view. Cell 148, 1258-1270.
2. Sender, R., Fuchs, S. and Milo, R. (2016) Revised Estimates for the Number of Human and Bacteria Cells in the Body. PLoS Biol 14, e1002533.
3. Thursby, E. and Juge, N. (2017) Introduction to the human gut microbiota. Biochem J 474, 1823-1836.
4. Arumugam, M., Raes, J., Pelletier, E., Le Paslier, D., Yamada, T., Mende, D. R., Fernandes, G. R., Tap, J., Bruls, T., Batto, J. M., Bertalan, M., Borruel, N., Casellas, F., Fernandez, L., Gautier, L., Hansen, T., Hattori, M., Hayashi, T., Kleerebezem, M., Kurokawa, K., Leclerc, M., Levenez, F., Manichanh, C., Nielsen, H. B., Nielsen, T., Pons, N., Poulain, J., Qin, J., Sicheritz-Ponten, T., Tims, S., Torrents, D., Ugarte, E., Zoetendal, E. G., Wang, J., Guarner, F., Pedersen, O., de Vos, W. M., Brunak, S., Dore, J., Meta, H. I. T. C., Antolin, M., Artiguenave, F., Blottiere, H. M., Almeida, M., Brechot, C., Cara, C., Chervaux, C., Cultrone, A., Delorme, C., Denariaz, G., Dervyn, R., Foerstner, K. U., Friss, C., van de Guchte, M., Guedon, E., Haimet, F., Huber, W., van Hylckama-Vlieg, J., Jamet, A., Juste, C., Kaci, G., Knol, J., Lakhdari, O., Layec, S., Le Roux, K., Maguin, E., Merieux, A., Melo Minardi, R., M'Rini, C., Muller, J., Oozeer, R., Parkhill, J., Renault, P., Rescigno, M., Sanchez, N., Sunagawa, S., Torrejon, A., Turner, K., Vandemeulebrouck, G., Varela, E., Winogradsky, Y., Zeller, G., Weissenbach, J., Ehrlich, S. D. and Bork, P. (2011) Enterotypes of the human gut microbiome. Nature 473, 174-180.
5. Wu, G. D., Chen, J., Hoffmann, C., Bittinger, K., Chen, Y. Y., Keilbaugh, S. A., Bewtra, M., Knights, D., Walters, W. A., Knight, R., Sinha, R., Gilroy, E., Gupta, K., Baldassano, R., Nessel, L., Li, H., Bushman, F. D. and Lewis, J. D. (2011) Linking long-term dietary patterns with gut microbial enterotypes. Science 334, 105-108.
6. Claesson, M. J., Jeffery, I. B., Conde, S., Power, S. E., O'Connor, E. M., Cusack, S., Harris, H. M., Coakley, M., Lakshminarayanan, B., O'Sullivan, O., Fitzgerald, G. F., Deane, J., O'Connor, M., Harnedy, N., O'Connor, K., O'Mahony, D., van Sinderen, D., Wallace, M., Brennan, L., Stanton, C., Marchesi, J. R., Fitzgerald, A. P., Shanahan, F., Hill, C., Ross, R. P. and O'Toole, P. W. (2012) Gut microbiota composition correlates with diet and health in the elderly. Nature 488, 178-184.
7. Jandhyala, S. M., Talukdar, R., Subramanyam, C., Vuyyuru, H., Sasikala, M. and Nageshwar Reddy, D. (2015) Role of the normal gut microbiota. World J Gastroenterol 21, 8787-8803.
8. Koh, A., De Vadder, F., Kovatcheva-Datchary, P. and Backhed, F. (2016) From Dietary Fiber to Host Physiology: Short-Chain Fatty Acids as Key Bacterial Metabolites. Cell 165, 1332-1345.
9. Jie, Z., Xia, H., Zhong, S. L., Feng, Q., Li, S., Liang, S., Zhong, H., Liu, Z., Gao, Y., Zhao, H., Zhang, D., Su, Z., Fang, Z., Lan, Z., Li, J., Xiao, L., Li, J., Li, R., Li, X., Li, F., Ren, H., Huang, Y., Peng, Y., Li, G., Wen, B., Dong, B., Chen, J. Y., Geng, Q. S., Zhang, Z. W., Yang, H., Wang, J., Wang, J., Zhang, X., Madsen, L., Brix, S., Ning, G., Xu, X., Liu, X., Hou, Y., Jia, H., He, K. and Kristiansen, K. (2017) The gut microbiome in atherosclerotic cardiovascular disease. Nat Commun 8, 845.
10. LeBlanc, J. G., Milani, C., de Giori, G. S., Sesma, F., van Sinderen, D. and Ventura, M. (2013) Bacteria as vitamin suppliers to their host: a gut microbiota perspective. Curr Opin Biotechnol 24, 160-168.
11. Suarez-Zamorano, N., Fabbiano, S., Chevalier, C., Stojanovic, O., Colin, D. J., Stevanovic, A., Veyrat-Durebex, C., Tarallo, V., Rigo, D., Germain, S., Ilievska, M., Montet, X., Seimbille, Y., Hapfelmeier, S. and Trajkovski, M. (2015) Microbiota depletion promotes browning of white adipose tissue and reduces obesity. Nat Med 21, 1497-1501.
12. Chevalier, C., Stojanovic, O., Colin, D. J., Suarez-Zamorano, N., Tarallo, V., Veyrat-Durebex, C., Rigo, D., Fabbiano, S., Stevanovic, A., Hagemann, S., Montet, X., Seimbille, Y., Zamboni, N., Hapfelmeier, S. and Trajkovski, M. (2015) Gut Microbiota Orchestrates Energy Homeostasis during Cold. Cell 163, 1360-1374.
13. Worthmann, A., John, C., Ruhlemann, M. C., Baguhl, M., Heinsen, F. A., Schaltenberg, N., Heine, M., Schlein, C., Evangelakos, I., Mineo, C., Fischer, M., Dandri, M., Kremoser, C., Scheja, L., Franke, A., Shaul, P. W. and Heeren, J. (2017) Cold-induced conversion of cholesterol to bile acids in mice shapes the gut microbiome and promotes adaptive thermogenesis. Nat Med 23, 839-849.
14. Zietak, M., Kovatcheva-Datchary, P., Markiewicz, L. H., Stahlman, M., Kozak, L. P. and Backhed, F. (2016) Altered Microbiota Contributes to Reduced Diet-Induced Obesity upon Cold Exposure. Cell Metab 23, 1216-1223.
15. Watanabe, M., Houten, S. M., Mataki, C., Christoffolete, M. A., Kim, B. W., Sato, H., Messaddeq, N., Harney, J. W., Ezaki, O., Kodama, T., Schoonjans, K., Bianco, A. C. and Auwerx, J. (2006) Bile acids induce energy expenditure by promoting intracellular thyroid hormone activation. Nature 439, 484-489.
16. Lutgendorff, F., Akkermans, L. M. and Soderholm, J. D. (2008) The role of microbiota and probiotics in stress-induced gastro-intestinal damage. Curr Mol Med 8, 282-298.
17. Yan, F., Cao, H., Cover, T. L., Washington, M. K., Shi, Y., Liu, L., Chaturvedi, R., Peek, R. M., Jr., Wilson, K. T. and Polk, D. B. (2011) Colon-specific delivery of a probiotic-derived soluble protein ameliorates intestinal inflammation in mice through an EGFR-dependent mechanism. J Clin Invest 121, 2242-2253.
18. Gordon, H. A. and Bruckner-Kardoss, E. (1961) Effect of normal microbial flora on intestinal surface area. Am J Physiol 201, 175-178.
19. Banasaz, M., Norin, E., Holma, R. and Midtvedt, T. (2002) Increased enterocyte production in gnotobiotic rats mono-associated with Lactobacillus rhamnosus GG. Appl Environ Microbiol 68, 3031-3034.
20. Husebye, E., Hellstrom, P. M. and Midtvedt, T. (1994) Intestinal microflora stimulates myoelectric activity of rat small intestine by promoting cyclic initiation and aboral propagation of migrating myoelectric complex. Dig Dis Sci 39, 946-956.
21. Guarner, F. and Malagelada, J. R. (2003) Gut flora in health and disease. Lancet 361, 512-519.
22. Guinane, C. M. and Cotter, P. D. (2013) Role of the gut microbiota in health and chronic gastrointestinal disease: understanding a hidden metabolic organ. Therap Adv Gastroenterol 6, 295-308.
23. Selber-Hnatiw, S., Rukundo, B., Ahmadi, M., Akoubi, H., Al-Bizri, H., Aliu, A. F., Ambeaghen, T. U., Avetisyan, L., Bahar, I., Baird, A., Begum, F., Ben Soussan, H., Blondeau-Ethier, V., Bordaries, R., Bramwell, H., Briggs, A., Bui, R., Carnevale, M., Chancharoen, M., Chevassus, T., Choi, J. H., Coulombe, K., Couvrette, F., D'Abreau, S., Davies, M., Desbiens, M. P., Di Maulo, T., Di Paolo, S. A., Do Ponte, S., Dos Santos Ribeiro, P., Dubuc-Kanary, L. A., Duncan, P. K., Dupuis, F., El-Nounou, S., Eyangos, C. N., Ferguson, N. K., Flores-Chinchilla, N. R., Fotakis, T., Gado Oumarou, H. D. M., Georgiev, M., Ghiassy, S., Glibetic, N., Gregoire Bouchard, J., Hassan, T., Huseen, I., Ibuna Quilatan, M. F., Iozzo, T., Islam, S., Jaunky, D. B., Jeyasegaram, A., Johnston, M. A., Kahler, M. R., Kaler, K., Kamani, C., Karimian Rad, H., Konidis, E., Konieczny, F., Kurianowicz, S., Lamothe, P., Legros, K., Leroux, S., Li, J., Lozano Rodriguez, M. E., Luponio-Yoffe, S., Maalouf, Y., Mantha, J., McCormick, M., Mondragon, P., Narayana, T., Neretin, E., Nguyen, T. T. T., Niu, I., Nkemazem, R. B., O'Donovan, M., Oueis, M., Paquette, S., Patel, N., Pecsi, E., Peters, J., Pettorelli, A., Poirier, C., Pompa, V. R., Rajen, H., Ralph, R. O., Rosales-Vasquez, J., Rubinshtein, D., Sakr, S., Sebai, M. S., Serravalle, L., Sidibe, F., Sinnathurai, A., Soho, D., Sundarakrishnan, A., Svistkova, V., Ugbeye, T. E., Vasconcelos, M. S., Vincelli, M., Voitovich, O., Vrabel, P., Wang, L., Wasfi, M., Zha, C. Y. and Gamberi, C. (2017) Human Gut Microbiota: Toward an Ecology of Disease. Front Microbiol 8, 1265.
24. Ley, R. E., Backhed, F., Turnbaugh, P., Lozupone, C. A., Knight, R. D. and Gordon, J. I. (2005) Obesity alters gut microbial ecology. Proc Natl Acad Sci U S A 102, 11070-11075.
25. Zhang, H., DiBaise, J. K., Zuccolo, A., Kudrna, D., Braidotti, M., Yu, Y., Parameswaran, P., Crowell, M. D., Wing, R., Rittmann, B. E. and Krajmalnik-Brown, R. (2009) Human gut microbiota in obesity and after gastric bypass. Proc Natl Acad Sci U S A 106, 2365-2370.
26. Brown, J. M. and Hazen, S. L. (2017) Targeting of microbe-derived metabolites to improve human health: The next frontier for drug discovery. J Biol Chem 292, 8560-8568.
27. Blacher, E., Levy, M., Tatirovsky, E. and Elinav, E. (2017) Microbiome-Modulated Metabolites at the Interface of Host Immunity. J Immunol 198, 572-580.
28. Williamson, G. (2017) The role of polyphenols in modern nutrition. Nutr Bull 42, 226-235.
29. Ryu, D., Mouchiroud, L., Andreux, P. A., Katsyuba, E., Moullan, N., Nicolet-Dit-Felix, A. A., Williams, E. G., Jha, P., Lo Sasso, G., Huzard, D., Aebischer, P., Sandi, C., Rinsch, C. and Auwerx, J. (2016) Urolithin A induces mitophagy and prolongs lifespan in C. elegans and increases muscle function in rodents. Nat Med 22, 879-888.
30. Rafii, F. (2015) The role of colonic bacteria in the metabolism of the natural isoflavone daidzin to equol. Metabolites 5, 56-73.
첨부파일