
생화학분자생물학회입니다.
자기 공명을 이용한 체외 진단 기술의 기발 (Clinical Diagnostic Platform Based on Magnetic Resonance)
작성자
관리자작성일자
2017-04-01조회수
475자기 공명을 이용한 체외 진단 기술의 기발
(Clinical Diagnostic Platform Based on Magnetic Resonance)

이학호
Center for Systems Biology, Massachusetts General Hospital,Harvard Medical School
I. 서론
신체에서 쉽게 채취할 수 있는 액체시료(혈액, 소변)로부터 바이오 마커를 검출할 수 있는 체외진단 센서 및 신속하고 민감하게 표지물질을 분석하는 기술은 임상에서 현재의 기술적 한계를 뛰어넘는 중요한 역할을 기대할 수 있다. 이러한 진단 센서는 특히 질병의 조기 진단 및 포괄적인 특성 규명에 사용될 수 있을 뿐만 아니라, 더 나아가 치료과정에 따른 환자 개개인의 치유정도를 모니터링하는 수단으로 사용될 수 있어 “맞춤형 치료” 시대를 앞당길 것으로 기대된다.
이를 목적으로 현재 광학적, 전기적, 또는 자기적 성질을 가지는 물질을 이용한 다양한 종류의 바이오 센서들이 개발되고 있다. 이중 자성 나노 입자(Magnetic Nanoparticle, MNPs)를 기반으로 한 센서는 높은 민감도를 얻을 수 있어 주목을 받고 있다. 검출 하고자 하는 타겟(세포, 바이러스 등)이 MNP로 태깅되면 이러한 타겟들은 주변 배경에 비해 높은 자기적인 신호를 만들어낸다. 대부분의 생물체는 물과 비슷한 자기 감수성을 가지고 있기 때문에 태깅되지 않은 다른 물질은 광학적으로 불투명하더라도 자기적으로는 투명하게 보일 수 있어 이로부터 주변물질 자체에 의한 신호 간섭을 줄일 수 있다.
우리 실험실에서는 자성 나노 입자를 이용한 바이오 마커 검출을 위해 자기 공명을 이용한 센싱 플랫폼 인 진단 자기 공명 장치(Diagnostic Magnetic Resonance; DMR)를 지속적으로 개발하고 있다. DMR은 핵 자기 공명(Nuclear Magnetic Resonance; NMR)을 기반으로 하여, NMR 자기장 안에서 만들어지는 MNPs의 자체 자기장에 의해 변화되는 주변 물 분자의 이완 속도(Relaxation Rate)를 측정한다. 하나의 MNP가 주변에 위치하는 수백만 개의 물 분자에 영향을 줄 수 있어 매우 작은 농도의 MNP로도 강한 신호를 얻을 수 있으며, 또한 신호가 복잡한 MNP 태깅 후 분리/정제 과정없이 바로 얻어지기 때문에 검출 분석이 단순한 장점이 있다. 우리 실험실에서는 MNPs를 최적화하고 NMR 검출기를 소형화하는 등 DMR을 이용한 체외진단기술을 체계적으로 발전시켜 왔으며, 또한 핵산, 단백질, 약물, 박테리아 및 종양 세포 등을 포함한 광범위한 표적에 대해 임상학적 가능성을 확인하였다.
II. 본론
1. 새 자성 입자의 개발
시료 안에서 MNP는 국부적인 자기 필드를 생성하며, 이 필드는 물 양성자 스핀의 Relaxation에 영향을 미친다. 이러한 영향의 거시적인 효과는 NMR 신호의 T2(스핀 – 스핀) 시간을 단축시키는 것으로 측정된다. T2 시간을 감소시키는 MNP의 효과는 r2 로 정의되는데, 이론적으로 MNP의 입자의 크기가 클수록 그리고 자성이 강할수록 r2 는 증가하게 된다. 따라서 r2 를 향상시키기 위한 노력은 자기적으로 강한 물질을 사용하여 보다 큰 MNP를 합성하는 데 초점을 맞추었다.
우리 실험실에서는 다양한 종류의 MNP을 합성하였는데 그 중에 순수 철(Fe)을 이용한 입자가 가장 높은 r2 를 가지고 있다 (1). Fe은 산화철(Ferrite) 보다 강한 자성을 가지고 있어 MNP의 이상적인 구성 요소로서 제안되어 왔다. Fe는 강자성체 결정 중에서 가장 높은 포화 자화(Saturation Magnetization)와 상대적으로 낮은 결정 이방성(Magnetic Anisotropy)을 가진다. 따라서 높은 자기 모멘트를 지니지만, 상대적으로 분산이 잘되는 Superparamagnetic Fe MNP의 제조가 가능하다. 그러나 철은 산소에 매우 민감하게 반응하기 때문에 이를 막기 위한 방법이 필요하다.
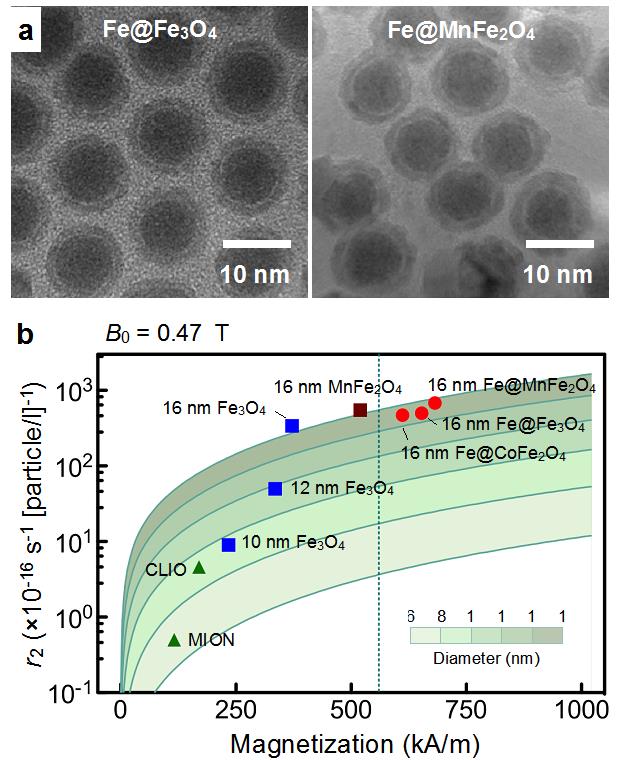
그림 1. 새로운 조성의 MNP. (a) Fe-Core, Ferrite Shell MNPs. (b) 다양한 MNP의 나노 입자의 포화 자화값과 r2 값의 비교 그래프.
우리는 최근 철의 산화를 막으면서 입자의 자성을 극대화하는 새로운 유형의 Fe-MNP를 개발하였다 (그림 1a). 이 입자는 Fe-Core와 이를 보호하는 Ferrite Shell로 구성된 하이브리드 구조 (Fe@ferrite)를 가지고 있다. 먼저, Fe-core 입자는 Fe-Pentacarbonyl의 열분해를 통해 형성되었다. 입자 크기는 반응 온도에 비례하여 증가함을 확인했는데, 온도 조절을 통해 직경 16 nm까지의 입자를 합성할 수 있었다. 다음으로, 우리는 합성된 Fe MNP의 표면에 Ferrite Shell을 코팅하였다. Ferrite 뿐만 아니라 합성된 입자의 자성을 향상시키기 위해 다른 금속 도핑을 하여, 총 세가지 종류의 입자를 생성하였다 (Fe@MFe2O4, M = Mn, Co, Fe). 이 방법으로 합성된 입자는 산소에 의한 변형에 대해 높은 저항성을 나타냈으며, 또한 일반 Ferrite 보다 높은 포화 자화값(796 kA/m) 및 r2 (>400%) 값을 가졌다 (그림 1b) (1). 특히 DMR을 이용한 바이오시료 분석결과, Fe@MnFe2O4 MNP는 pM Level의 단백질 및 단일 암세포를 검출하는 등, 우수한 검출성능을 보였다.
2. 소형 검출 시스템의 개발
DMR 테스트의 사용 편의성 및 현장 진단의 가능성을 높이기 위한 NMR 장치의 소형화는 여러 가지 장점을 제공한다 (2). 첫째, 시료 용량을 줄임으로써 분석의 한계(Mass Detection Limit)를 낮출 수 있다. 둘째, 소형화된 NMR 코일은 강한 RF(Radio-Frequency) 자기장을 생성하여 민감도를 증진시킨다. 셋째, NMR 코일 작아짐에 따라 NMR 자기장을 생성하기 위해 소형 휴대용 자석을 사용할 수 있다. 우리 실험실에서는 일련의 시스템 최적화를 통해 바이오마커 검출용 NMR 장비 소형화 연구를 진행하였다. 첫 번째 프로토 타입 (그림 2a) 을 통해 소형화 가능성을 확인하였고 (3), 또한 CMOS(Complementary Metal Oxide Semiconductor) 기술을 이용하여, 현존하는 가장 작은 DMR 시스템 (그림 2b) 개발에 성공하였다 (4). 뿐만 아니라 최근에는 일상적인 임상 애플리케이션에 최적화 된 3세대 시스템을 최적화하였다 (그림 2c) (5).
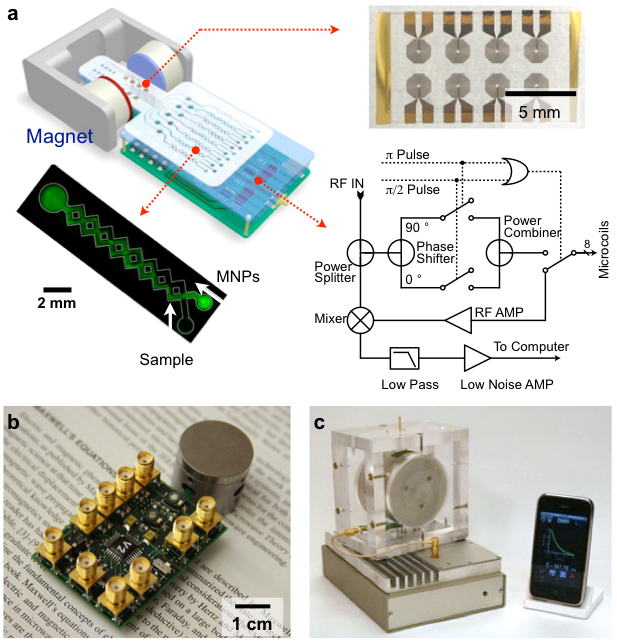
그림 2. 소형화 된 DMR 장비의 개발. (a) 프로토 타입 디바이스. (b) 집접회로 기술을 이용하여 구현된 휴대용 시스템. (c) 임상응용의 편의성을 위해 개발된 소형화 장비.
임상 환경에서 DMR 측정 시, 오류를 초래할 수 있는 가장 중요 요인은 온도에 대한 시스템 고유의 반응이다. 이는 NMR Field를 생성하는 영구 자석의 자기장이 온도에 따라 변하기 때문에 발생한다. 즉, 자기장의 변화는 시료자체의 고유한 NMR 주파수를 변화시키는데 비해 장비는 고정된 NMR 주파수에 최적화 되어 있어, 측정된 T2 값에 오류가 발행하게 된다. 실험실 환경에서는 주변의 및 자석의 온도를 제어하여 이러한 문제를 해결할 수 있으나, 이러한 방법은 시스템의 비용과 크기를 크게 증가시켜 실제 임상에서 적용이 어려운 단점이 있다. 우리가 개발한 3세대 장비에서는 이러한 문제를 전자적인 방식을 통해 해결했다. 즉, 장비가 먼저 예비 NMR측정을 통해, 온도 변화를 자동으로 감지하고 그에 따라 측정 설정을 다시 구성하는 피드백 루틴을 구현하였다. 이 방법은 별도의 하드웨어 추가 없이도 오류가 거의 없는 DMR 측정을 가능하게 하였다. 3세대 장비는 또한 일반적으로 구할 수 있는 IC칩을 사용하여 조립함으로써 시스템 비용을 절감했으며 (<$ 200), 기기 작동을 모바일 장치(iPAD, iPhone)로 모니터링 할 수 있도록 구현하여 사용 편의성을 높였다. 이 장비는 현재 암, 감염 진단 등의 여러 임상 시험에 사용되고 있다.
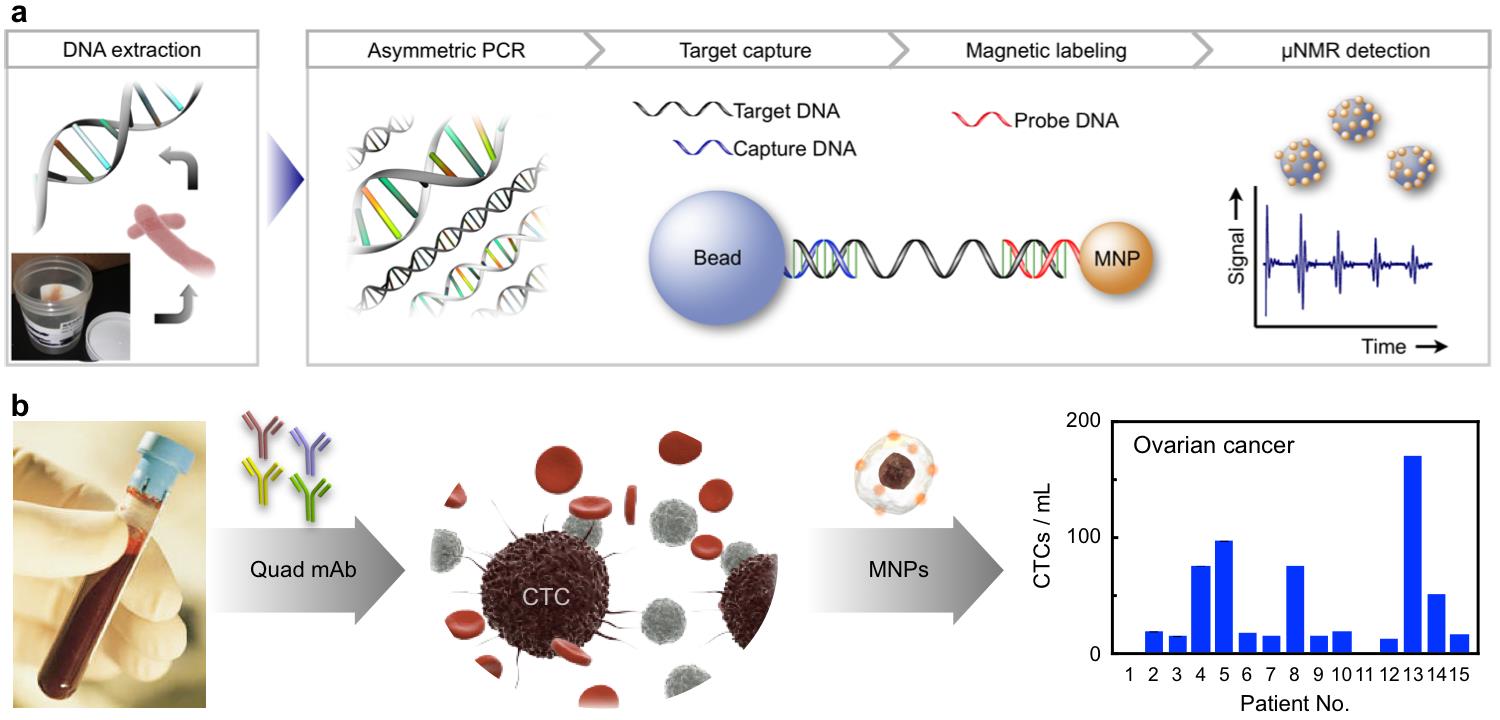
그림 3. DMR의 응용. (a) 박테리아 검출. (b) 환자 혈액에서의 혈중 순환 암세포의 검출.
II.3. DMR의 임상 적용
우리는 DMR의 임상학적 응용 가능성을 확인하기 위해 이를 이용한 박테리아 및 종양 검출 진단법을 확립하였다. 박테리아 검출의 경우, 박테리아의 Genomic DNA 또는 16s rRNA를 표적으로 삼았으며 (6, 7), 이러한 표적을 먼저 PCR을 통해 증폭시킨 후, 생성된 Amplicon을 마이크로비드에 Capture 하고 이를 MNP로 검출하였다. 개발된 분석법은 2.5 시간 내에 단일 박테리아까지 검출할 수 있었으며, 일반적인 PCR 방식과 비교하여 전혈과 객담에서 복잡한 정제과정 없이 바로 박테리아를 검출할 수 있는 장점을 보여주었다. 암 세포의 검출에는 다중 마커 타겟팅 방식이 사용되었는데, 선행 연구에서 선정된 암 진단에 96%의 정확도를 나타낼 수 있는 마커 HER2, EGFR, EpCAM 및 MUC1을 타겟팅 하였다 (8). 이러한 단백질 마커에 특이적인 항체를 이용하여 MNP를 세포에 고정화함으로써 세포 표면에 위치하는 마커의 양을 정량화하고, 이로부터 종양세포 여부를 진단할 수 있었으며 분석법은 실제 난소 암 환자로부터 채취된 혈액에서 순환 종양 세포(CTC)를 검출하는데 응용되었다. DMR로부터 얻은 CTC 수와 임상적인 소견은 좋은 일치를 보였는데, 한 예로 평균 CTC 수치는 난소암 4기 혹은 항암 치료에 저항성을 보인 환자에서 더 높게 나타났다 (9).
III. 결론
DMR은 진단 센서에 요구되는 분석 민감도, 정확성, 저비용 및 휴대성 등의 많은 요구사항을 충족시키는 중요한 기술이며, 특히 최소 침습적으로 얻어진 시료에 대해 전처리 과정을 최소화 하면서 빠른 시간에 분석할 수 있는 장점을 가지고 있다. 소형 진단 기기의 개발 및 최적화 된 자성 나노 물질의 합성 등의 새로운 기술 개발은 DMR의 임상 적용을 더욱 가속화 할 것이며, 이는 차세대 개인 맞춤형 의료의 활성화에 크게 기여할 것으로 기대된다.
참고문헌
1. Yoon, T. J., Lee, H., Shao, H. & Weissleder, R. (2011). Highly magnetic core-shell nanoparticles with a unique
magnetization mechanism. Angew Chem Int Ed Engl 50, 4663–4666.
2. Castro, C. M., Ghazani, A. A., Chung, J., Shao, H., Issadore, D., Yoon, T. J., Weissleder, R. & Lee, H. (2014).
Miniaturized nuclear magnetic resonance platform for detection and profiling of circulating tumor cells. Lab Chip 14, 14–23.
3. Lee, H., Sun, E., Ham, D. & Weissleder, R. (2008). Chip-NMR biosensor for detection and molecular analysis of
cells. Nat Med 14, 869–874.
4. Sun, N., Liu, Y., Lee, H., Weissleder, R. & Ham, D. (2009). CMOS RF Biosensor Utilizing Nuclear Magnetic
Resonance. IEEE J Solid-State Circuits 44, 1629–1643.
5. Issadore, D., Min, C., Liong, M., Chung, J., Weissleder, R. & Lee, H. (2011). Miniature magnetic resonance system
for point-of-care diagnostics. Lab Chip 11, 2282–2287.
6. Liong, M., Hoang, A. N., Chung, J., Gural, N., Ford, C. B., Min, C., Shah, R. R., Ahmad, R., Fernandez-Suarez, M.
& other authors (2013). Magnetic barcode assay for genetic detection of pathogens. Nat Commun 4, 1752.
7. Chung, H. J., Castro, C. M., Im, H., Lee, H. & Weissleder, R. (2013). A magneto-DNA nanoparticle system for rapid
detection and phenotyping of bacteria. Nat Nanotechnol 8, 369–375.
8. Haun, J. B., Castro, C. M., Wang, R., Peterson, V. M., Marinelli, B. S., Lee, H. & Weissleder, R. (2011).
Micro-NMR for Rapid Molecular Analysis of Human Tumor Samples. Sci Transl Med 3, 71ra16.
9. Ghazani, A. A., Castro, C. M., Gorbatov, R., Lee, H. & Weissleder, R. (2012). Sensitive and Direct Detection of
Circulating Tumor Cells by Multimarker micro-Nuclear Magnetic Resonance. Neoplasia 14, 388–395.
첨부파일