
생화학분자생물학회입니다.
Laboratory of microbial natural products chemistry (항암물질연구단 미생물천연물화학연구실)
작성자
관리자작성일자
2017-04-01조회수
606Laboratory of microbial natural products chemistry (항암물질연구단 미생물천연물화학연구실)
장재혁
한국생명공학연구원
[연구실소개]
미생물이 생산하는 이차대사산물은 다양한 생리활성을 갖고 있기 때문에 이들 화합물은 의약 개발을 위한 중요한 소재로서 오랫동안 이용되어 왔다. 실제로 세계적으로 임상에 사용하는 약 중에서 45% 이상이 이러한 이차대사산물 또는 이들을 모핵으로 하는 유도체에서 개발되었다. 이러한 대사산물의 의약물질로의 개발 가능성이 높은 이유는 대사산물은 생합성 효소에 의한 화학반응에 의해 생합성 된 물질이기 때문이다. 즉, 대사산물은 생체의 생합성 효소 등의 단백질과 연관되어 합성되는 화합물로서 다양한 화학골격과 입체적인 복잡한 구조를 갖고 있기 때문에 체내 단백질과 높은 interaction이 가능한 것으로 알려져 있다.
이에 본 연구실에서는 국내의 다양한 환경으로부터 분리한 육상 및 해양미생물의 배양물로부터 생리활성 이차대사산물을 분리하여 NMR 등의 각종 분광기기를 이용하여 화학구조를 결정하며, 이들 물질의 대사질환 및 항암 등 다양한 의약활성을 발굴하고 chemical biology 기술을 접목해서 bioprobe로 개발, 의약활성 기작과 타겟을 규명을 목적으로 하는 연구를 진행하고 있다. 이를 위해서 국내 미이용 미생물자원의 발굴, 미생물의 생리활성물질 생산 유도화법과 케모인포메틱스-활성 스크리닝 시스템을 갖춘 생리활성 이차대사산물 라이브러리를 구축을 통하여, 항암제, 암전이억제제 및 항암/면역치료제 타겟인 Indoleamine 2,3-dioxygenase (IDO) 효소 저해제 등을 발굴하고 있다.
[연구내용]
1. 생리활성물질 생산 유도법을 통한 신규 유효물질 발굴
미생물로부터 신규 생리활성물질 탐색 시에 가장 큰 문제점은 기지물질의 재발견이다. 미생물 내에는 생리활성물질 생합성에 관여하는 많은 유전자군이 존재를 한다. 반면, 연구실 환경에서 조성해 주는 배양환경에서는 발현되지 않는 silent gene 또한 수없이 존재하는 것으로 알려져 있다. 이런 잠재적 유전자군을 깨우는 것은 미생물의 신규 생리활성 이차대사사물을 생산할 수 있게 하는 원동력이 될 수 있다. 이러한 문제점을 극복하고 새로운 미생물 유래 생리활성물질을 발굴하기 위하여 하기와 같은 다양한 방법을 도입하여 미생물 배양을 수행하고 있다.
- OSMAC Approach (One Strain Many Compounds):
한 균주에 대하여 다양한 물리, 화학적 배양조건을 검토하여 일반 배양 조건에서 보다 다양한 대사산물 유도
- Co-Cultures (Interspecies Crosstalk):
서로 다른 미생물군의 혼합배양을 실시하여 단일균주배양에서 발현되지 않는 신규 대사산물 유도
- Epigenetic Remodeling:
유전자 발현 조절, DNA damage, genome stability에 관여하는 저해제 (HDAC, DNMT 저해제 등)를 배지에 처리한 신규 대사산물 유도
- Activation of Pathway-Specific Regulatory Genes:
생리활성물질 생산에 관여하는 특정 유전자를 발굴하여, 생산성이 좋은 대장균에서 신규 대사산물 발현 유도
2. 국내외 특수환경에서 다양한 미생물을 분리 확보, 미생물 배양물의 Metabolite Fraction Library 및 순수화합물 라이브러리 구축
본 연구실에서 분리 및 수집 확보한 유용 미생물자원(신종, 희귀종, 특수환경의 육상, 해양미생물 등)들은 의약활성물질의 개발을 위한 자원으로 활용할 수 있으며 분리된 생리활성 대사산물들은 생리활성물질 라이브러리로 구축 및 보존되면서, 새로운 의약후보물질의 개발을 위한 탐색자원과 물질자원으로 활용할 수 있다. 이에 본 연구진은 다양한 물리화학적 정보(HPLC Profile, PDA, UV, MS 및 Structure Database)를 갖춘 미생물 배양물 Metabolite Fraction Library 구축과 ”Chemo-Informatics 기반 신규 생리활성물질 발굴법”을 적용하여 화학구조의 다양성 확보 및 신규 화합물 도출의 확률을 높이고 있다.
아울러, PTP1B 저해, Indoleamine 2,3-dioxygenase(IDO) 저해, 암세포 증식 저해, 암세포전이(침윤, 운동성) 저해, Osteoclast 분화 조절, 항균 활성, 항산화 활성, 항염증, 자가소화작용 활성 검증계 등의 in vitro 혹은 Cell-Based Assay System이 본 연구그룹에 구축되어 있으며, 대사산물의 생리활성 발굴의 효율성을 높이기 위하여 생명연 내 타 연구그룹 및 해외공동연구파트너인 일본 RIKKEN화학생물연구그룹의 다양한 활성평가계를 활용하고 있다.
본 연구실에서 발굴한 신규 이차대사산물로는 곰팡이 유래 암세포 이동성 조절물질인 Fusarisetin A, 울릉도 토양 방선균 유래 항균활성물질인 Ulleungamides, 금산 인삼밭 토양곰팡이 유래 항암활성, Geumsanols, 보성 녹차밭 토양방선균 유래 Boseongazepins, 해남 해양퇴적물 곰팡이 유래 Haenamindole등이 있으며, 이러한 신규 활성물질들의 후속연구를 성공적으로 수행하여 항암활성이나 항비만/당뇨 치료제 선도물질로서 제조나 생산에 대한 관련 특허의 확보가 가능하며 물질특허 외에도 이의 활용에 의한 새로운 의약물질로의 개발도 가능하다. 또한, 구축된 순수화합물라이브러리의 물질들 중 일부는 신규물질이거나 생리활성 작용이 기 보고된 적 없는 기지물질들로 연구수행 중 사장될 수 있는 기지물질의 새로운 쓰임새 전환(Drug-Repositioning)을 통해 항암, 항당뇨 의약이나 식품/의약소재로 개발할 수 있는 새로운 가치를 부여할 수 있을 것이다. 그리고 이들 물질들은 in-vivo 의약활성 평가에서 치료효과 등의 약리활성이 입증되면 새로운 의약활성물질 개발을 위한 작용기작에 대한 연구방향을 제시할 수 있다.
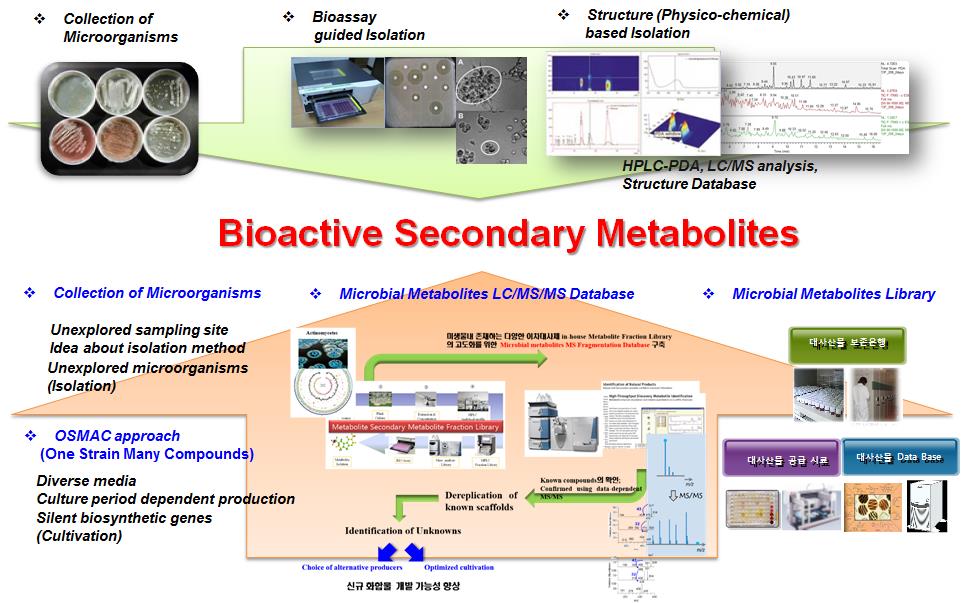
그림 1. 미생물로부터 생리활성 대사산물의 분리확보 및 라이브러리 구축
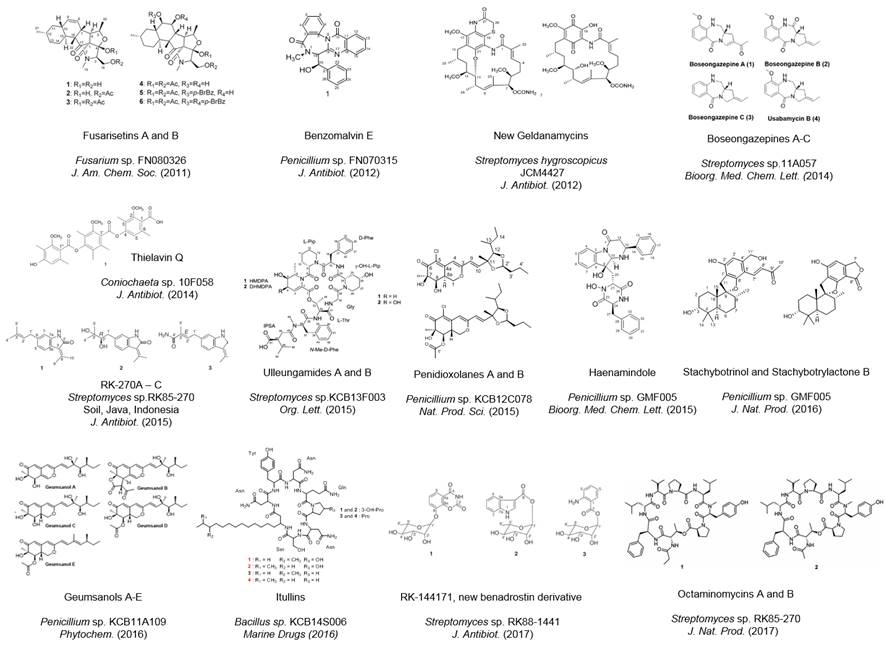
그림 2. 본 그룹 도출 미생물 유래 신규 생리활성 대사산물
2. Indoleamine 2,3-dioxygenase (IDO) 저해제 개발
Indoleamine 2,3-dioxygenase(IDO)는 hemerin을 포함하고 필수아미노산인 Tryptophan의 이화작용에 관여하는 속도 제한효소로서, Tryptophan에 산소원자를 추가하여 인돌핵을 개열하여 N-formylkynurenine의 생성을 촉진시키고 이는 급격하게 분해되어 Kynurenine으로 전환된다. Kynureine 대사경로(Kynurenine Metabolic Pathway)를 통한 Tryptophan의 이화작용으로 생성된 Kenurenine 등의 대사물질들은 면역T-세포의 활동결핍을 유발하여, T-세포의 증식을 억제하고 세포사멸을 유도하여 면역관용(Immune Tolerance)을 매개하는 것으로 알려져 있다. Tryptophan을 분해하는 효소인 IDO는 면역계를 포함하는 많은 세포에서 발견되고 있으며, 이것은 Tryptophan의 분해과정이 면역관용 유지에 있어 필수적이라는 것을 의미한다. IDO의 발현은 수지상세포와 대식세포를 포함한 섬유아세포, 외피세포, 내피세포 및 암세포 등의 다양한 세포에서 IFN-γ나 다른 염증성 사이토카인에 의해 유도되며 암, 알츠하이머, 백내장, HIV-뇌염 등의 질병 시에 발현이 증가함이 보고되었다. 또한, 종양세포에서 자체면역체계의 공격으로부터 자신을 보호하고자 하는 기전 중 하나로써 암세포에 대한 T-세포의 면역관용 발생 등 IDO의 발현이 보고되어 연구가 진행되었다. 이와 같은 연구는 체외세포배양에서 IDO를 발현하는 종양세포들이 면역세포의 공격을 받지 않고, 또한 IDO의 길항인자인 1-methylTryptophan의 종양의 과증식을 억제한다는 보고와 일치하는 결과이다. 따라서, IDO의 활성을 억제할 수 있는 활성물질은 암뿐만 아니라 면역성질환에도 효과적인 치료제로 사용될 수 있을 것으로 전망하고 있다. 본 연구실에서 발굴한 IDO 저해물질로는 오창 토양 곰팡이 유래 Thielavins과 대전 토양곰팡이 유래 Benzomalvins 등이 있다.
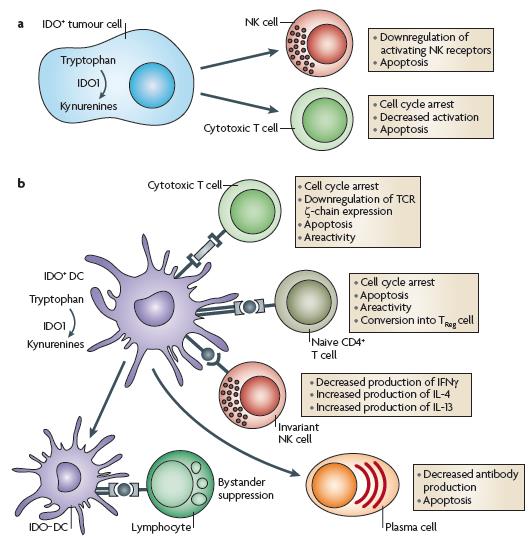
그림 3. Modulation of immune response by indoleamine 2,3-dioxygenase (IDO) expressing cells (출처: Nature Reviews, 9, 445-452, (2009))
[맺음말]
국내 고유 미생물자원 유래의 다종다양한 생리활성물질 확보를 통하여 국제 경쟁력을 보유한 신약 및 바이오소재 개발을 위한 기반기술 및 국가 인프라 구축에 기여할 수 있으며, 국외 생물자원이 아닌 미개발 순수 국내 미생물 자원의 적극적 활용도를 높여 나고야 의정서에도 대응할 수 있을 것이다. 아울러, 구축된 대사산물 라이브러리를 중심으로 한 다양한 의약활성소재 발굴을 보다 신속하고 효율적으로 진행하여 국내 미생물 자원으로부터 의약품 개발로의 순수 국내 개발 원천물질을 확보 및 활용도를 극대화시켜 합성화합물 라이브러리를 대체하는 보다 효율적인 향후 신약개발의 중요한 소스로 활용 가능하리라 사료된다.
[연구책임자]

장재혁 책임연구원
주소: 충청북도 청주시 청원구 오창읍 연구단지로 30
전화: 043-240-6164
팩스: 043-240-6169
E-mail: jangjh@kribb.re.kr
[연구진구성]
박사후 연구원: 장준필, 김종원
UST 박사과정: 손상근, 김길수, 황귀자
UST 석사과정: 김은
인턴연구원 : 강동효

[대표논문]
1. Jang, J.P., Nogawa, T., Futamura, Y., Shimizu, T., Hashizume, D., Takahashi, S., Jang, J.H., Ahn, J.S., Osada, H.
(2017) Octaminomycins A and B, cyclic octadepsipeptides active against Plasmodium falciparum.
J Nat Prod. 80(1):134-140
2. Kim, J.W., Ko, S.K., Kim, H.M., Kim, G.H., Son, S., Kim, G.S., Hwang, G.J., Jeon, E.S., Shin, K.S., Ryoo, I.J.,
Hong, Y.S., Oh, H., Lee, K.H., Soung, N.K., Hashizume, D., Nogawa, T., Takahashi, S., Kim, B.Y., Osada, H.,
Jang, J.H., Ahn, J.S. (2016) Stachybotrysin, an osteoclast differentiation inhibitor from the marine-derived
fungus Stachybotrys sp. KCB13F013. J Nat Prod. 79(10):2703-2708
3. Son, S., Ko, S.K., Jang, M., Kim, J.W., Kim, G.S., Lee, J.K., Jeon, E.S., Futamura, Y., Ryoo, I.J., Lee, J.S.,
Oh, H., Hong, Y.S., Kim, B.Y., Takahashi, S., Osada, H., Jang, J.H., Ahn, J.S. (2016) New cyclic lipopeptides
of the iturin class produced by saltern-derived Bacillus sp. KCB14S006. Mar Drugs. 14(4) pii: E72.
4. Kim, J.W., Ko, S.K., Son, S., Shin, K.S., Ryoo, I.J., Hong, Y.S., Oh, H., Hwang, B.Y., Hirota, H.,
Takahashi, S., Kim, B.Y., Osada, H., Jang, J.H., Ahn, J.S. (2015) Haenamindole, an unusual diketopiperazine
derivative from a marine-derived Penicillium sp. KCB12F005. Bioorg Med Chem Lett. 25(22):5398-5401
5. Son, S., Ko, S.K., Jang, M., Lee, J.K., Ryoo, I.J., Lee, J.S., Lee, K.H., Soung, N.K., Oh, H., Hong, Y.S.,
Kim, B.Y., Jang, J.H., Ahn, J.S. (2015) Ulleungamides A and B, modified α,β-dehydropipecolic acid containing
cyclic depsipeptides from Streptomyces sp. KCB13F003. Org Lett. 17(16):4046-4049
6. Oh, M., Jang, J.H., Choo, S.J., Kim, S.O., Kim, J.W., Ko, S.K., Soung, N.K., Lee, J.S., Kim, C.J., Oh, H.,
Hong, Y.S., Ueki, M., Hirota, H., Osada, H., Kim, B.Y., Ahn, J.S. (2014) Boseongazepines A-C,
pyrrolobenzodiazepine derivatives from a Streptomyces sp. 11A057. Bioorg Med Chem Lett. 24(7):1802-1804
7. Jang, J.P., Jang, J.H., Oh, M., Son, S., Kim, S.M., Kim, H.M., Shin, K.S., Oh, H., Soung, N.K., Hong, Y.S.,
Kim, B.Y., Ahn, J.S. (2014) Inhibition of indoleamine 2,3-dioxygenase by thielavin derivatives from a soil
fungus, Coniochaeta sp. 10F058. J Antibiot. 67(4):331-333
8. Jang, J.H., Asami, Y., Jang, J.P., Kim, S.O., Moon, D.O., Shin, K.S., Hashizume, D., Muroi, M., Saito, T., Oh, H.,
Kim, B.Y., Osada, H., Ahn, J.S. (2011) Fusarisetin A, an acinar morphogenesis inhibitor from a soil fungus,
Fusarium sp. FN080326. J Am Chem Soc. 133(18): 6865-6867