
생화학분자생물학회입니다.
Molecular and Integrative Biology(MIB) Lab
작성자
관리자작성일자
2018-04-01조회수
611Molecular and Integrative Biology(MIB) Lab
류동렬
부산대학교 한의과학과 및 유전체데이터과학 협동과정
[연구실소개]
본 실험실은 부산대학교 류동렬 교수가 이끄는 팀으로 현재 배성진 박사, 김승모, 정건희 석사과정 학생으로 구성되어 있다. “Molecular and Integrative Biology(MIB) Lab”이라는 실험실 이름에서 알 수 있듯이 전통적인 분자세포생물학적 접근법과 통합적이며 시스템적인 접근법을 균형있게 사용하는 연구를 지향하고 있다. 실제로 모든 구성원이 Dry 및 Wet Lab을 이용하여 프로젝트를 진행하고 있다. 대표적인 연구주제는 (1) BXD Genetic Reference Population(GRP)의 다중오믹스(multi-OMICS) 데이터를 이용한 대사, 근육, 노화 관련 질환 연구, (2) 장내 공생미생물 유래 대사체를 이용한 대사질환 및 근골격계 질환 치료제 개발, (3) Mitokines 및 Mitonucler Retrograde Signaling Pathway 동정 및 질환 관련성 연구, (4) 희귀 난치성 근육질환의 치료의 새로운 표적을 동정하는 연구 등이다. 상기 연구는 국내의 다양한 그룹과 공동연구를 통해서 수행하고 있을 뿐만 아니라 스위스 로잔연방공대(EPFL)의 Johan Auwerx 교수, 캐나다 오타와 대학의 Keir Menzies 교수, 중국 광주 중산대학의 Hongbo Zhang 교수, 스위스 취리히 대학의 Sokrates Stein 박사 팀 등을 포함하는 국외의 연구팀과 공동연구로 수행하고 있다. 위에서 언급된 연구 내용 중 2가지를 아래에서 조금 더 자세히 다루기로 하자.
[연구내용]
1. BXD Genetic Reference Population(GRP)의 다중오믹스(multi-OMICS) 데이터를 이용한 대사, 근육, 노화 관련 질환 연구
C57BL/6J(B6)와 DBA/2J(D2)의 근친교배계(Recombinant Inbred Line)인 BXD GRP는 1970년대에 Benjamin A. Taylor 등이 만든 것으로 알려져 있다. BXD GRP은 현재 186개의 근친교배계로 구성되어있다. BXD의 이름에서 유추할 수 있듯이 B6와 D2로부터 유래되었으며, F2세대 이후에서 무작위 그룹짓기를 진행하였고, 약 20세대 이상(+23세대)을 그룹 내부에서만 근친교배를 진행하여 근친교배계가 완성되었다 (그림 1). 이 과정에 B6와 D2 생쥐 유래의 SNP 중 하나만을 가지거나 또는 새로운 SNP이 생기거나 사라지기도 하는 일련의 과정이 진행되었을 것이며, 동시에 B6와 D2 생쥐 유래 대립유전자(Allele)들이 DNA 재조합(DNA Recombination) 등을 통해서 섞이게 되는 현상 등이 진행되었을 것이다. 다시 말해 동일한 유전적 배경에서 기원한 생쥐들이 다양하며 독특한 표현형(예: 색상, 체중, 수명, VO2 Max, 전사체, 단백체, 대사체 등)을 가지는 BXD GRP가 된 것이다.
최근의 OMICS 기술발전은 낡고 순유전학(Classical Forward Genetics)만의 도구라고 믿어진 BXD GRP를 대사질환 연구의 새롭고 유용한 도구로 자리매김하게 하였다. 현재 본 실험실에서는 스위스 Johan Auwerx 그룹의 도움으로 BXD GRP의 Genome(약 5백만 개의 SNPs을 포함하는 전체 유전체)과 Transcriptome(34개의 주요 장기에서 수집된 약 1천2백만 개의 전사체), 간의 Proteome, Metabolome(간, 근육, 혈청의 약 7십만 개의 대사체) 및 Phenome(약 5천 개의 표현형)을 확보하고 있다 (그림 1B). 최근에는 장내미생물 유래 대사물질이라고 할 수 있는 3천백여 개의 분변대사체(Fecal Metabolite)도 확보하였다. 이와 같이 수집된 빅데이터는 전통적인 생물정보학 접근 방식과 다중오믹스 방식을 병행하여, 각종 대사질환 표현형(OGTT AUC, Fasting Glucose Level, HOMA-IR 등) 및 이에 관련된 Genetic locus, Transcriptome, Proteome과 Metabolome을 동정하고, 대사질환의 분자생물학적 이해를 분자유전학적 이해를 기반으로 한 시스템적 이해를 본 실험실의 연구 목표로 하고 있다.
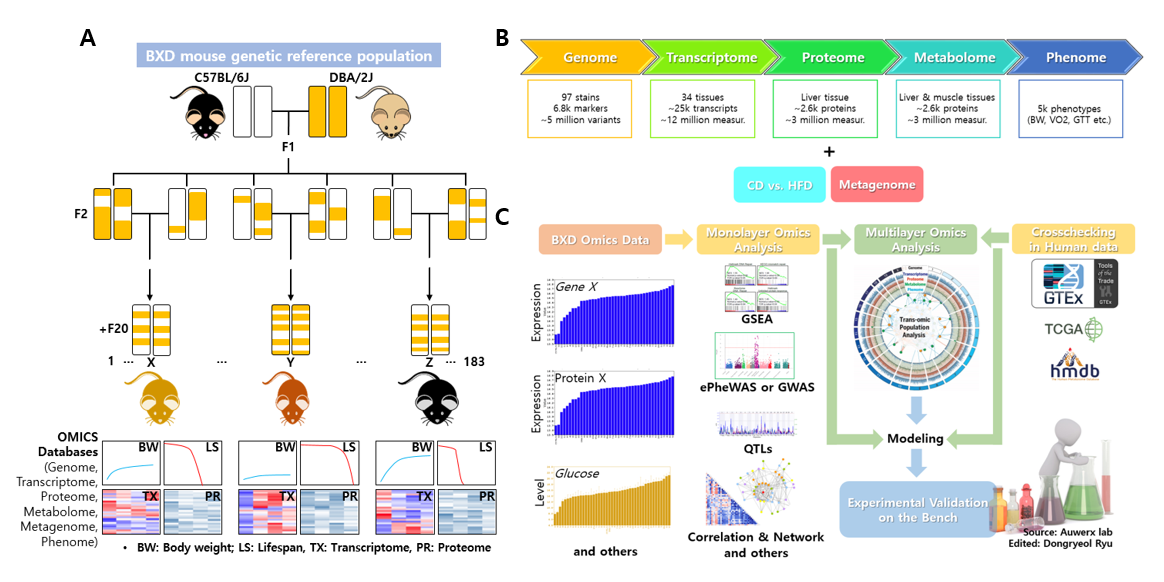
그림 1. BXD Genetic Reference Population의 개념. (A) BXD 모델의 생성 과정, (B) 현재 사용 가능한 오믹스 데이터, (C) BXD 오믹스 데이터를 이용한 연구법.
2. 장내 공생미생물 유래 대사체를 이용한 대사질환 및 근골격계 질환 치료제 개발
누구나 알다시피 장내 미생물 분야는 연구 열기가 가장 뜨거운 분야이다. 하루가 멀다 하고 쏟아지는 연구결과는 장내 미생물이 대사, 소화기, 염증성, 자가면역, 및 퇴행성 신경계 질환에 직접 또는 간접적으로 관여한다고 주장한다. 심지어 설치류 모델에서는 자폐증과 같은 사회적 행동에도 장내미생물이 영향을 주는 것으로 알려져 있다. 이 대목에서 우리가 주목해야 할 부분은 장내 공생미생물이 다양한 생리 병리 현상과 밀접한 연관성을 가진다는 연구가 “장내 미생물과 체내 조직 사이에 어떠한 형식의 커뮤니케이션이 존재함”을 증명하고 있다는 것이다. 다시 말하자면 장내 미생물에서 생산되어 분비된 무엇인가가 체내로 흡수되어 메신저로 작용할 것이며, 이 메신저 역할을 담당하는 분자를 동정하면 질환 치료에 응용할 수 있을 것이다. 다양한 연구를 통해 장내 미생물은 다양한 작은 대사체(Small Metabolite)를 생산하는 것으로 관찰되었다. 비타민 B, K2 등이 장내 미생물에 의해서 생산되는 것이 오래전부터 알려져 있었으며, 장내 미생물이 생산하는 작은 대사체인 Short Chain Fatty Acid(SCFA)가 장내 염증 반응과 에너지 대사에 직접 관여하는 것도 보고되었다. 본 연구자는 장내 미생물 유래 작은 대사체인 유롤리틴(Urolithin)이 체내에서 Autophagy 및 Mitophagy를 촉진하여 건강노화(Healthy Aging)를 유도한다고 보고하였다. 유롤리틴은 최근 임상 1상 시험을 성공리에 마무리하고, 현재 미국 시애틀에서 2상 시험이 진행 중이다.
본 연구실은 장내 미생물 유래 대사체가 대사질환 및 근골격계 질환에 영향을 줄 수 있다는 가설을 세우고 연구를 진행 중이다. 앞서 언급한 것처럼 BXD 모델에서 약 3,600여 개의 분변대산체(Fecal Metabolite)를 확보하였으며, 대사질환 관련 지표, 체성분 구성 지표, 운동능력 등과 같은 표현형체(Phenome)와 상관관계를 분석하여 후보 물질을 확보하였다. 이들 후보의 실제적인 효능을 다양한 in vitro 및 in vivo 실험을 통하여 검증할 계획이다. 이와는 별도로 식이 천연물에서 생산되는 대사체를 동정하는 연구도 진행할 계획이다.
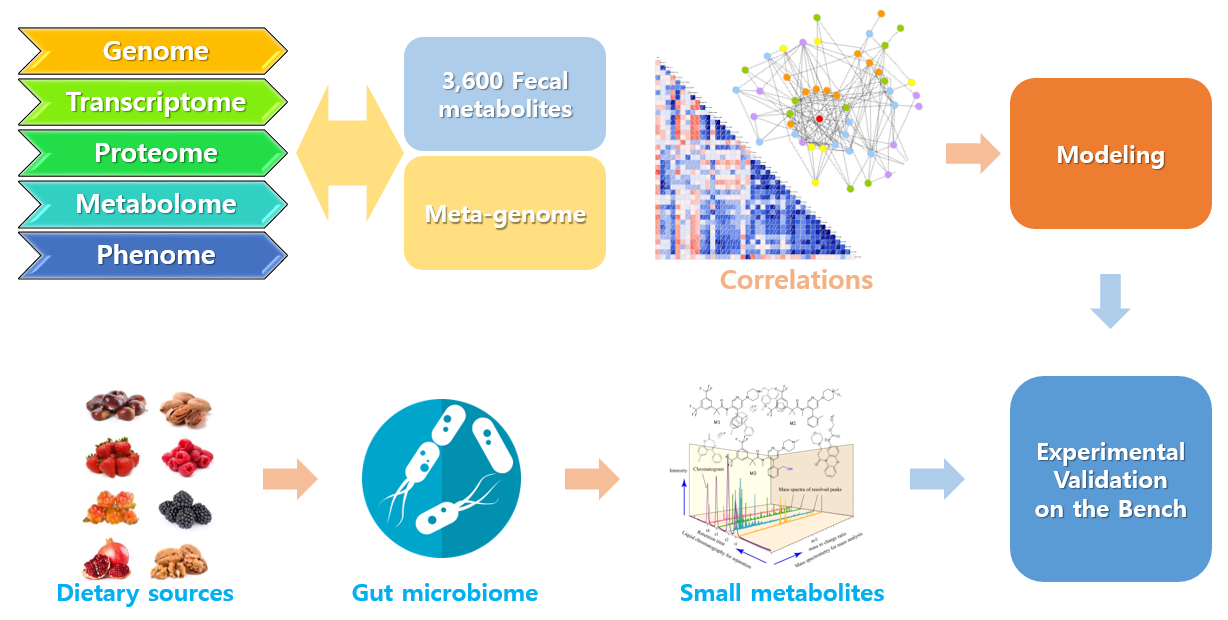
그림 2. 장내 공생미생물 유래 대사체 발굴 및 이를 이용한 연구의 개념도
앞에서 언급된 주제 외에도 노화, 대사질환, 근육질환에 중요한 인자로 알려진 미토콘드리아 생성, 제거 및 미토콘드리아 스트레스에 의해 활성화되는 것으로 알려진 일명 “Mitonucler Retrograde Signaling Pathway”를 동정하는 연구를 수행할 예정이다. 그리고 희귀 난치성 근육질환의 치료의 새로운 표적을 동정하는 연구도 본 실험실에서 관심을 가지고 있는 분야이다.
[연구책임자]

류동렬 교수
주소: 부산대학교 양산캠퍼스 한의학전문대학원 513호
전화: 051-510-8477
E-mail: dongryeolryu@pusan.ac.kr, dongryeol.ryu@gmail.com
Homepage: http://goo.gl/eBqjo7
[연구진구성]
박사후 연구원: 배성진
석사과정: 김승모, 정건희

[대표논문]
1. Kim, K., Ryu, D., Dongiovanni, P., Ozcan, L., Nayak, S., Ueberheide, B., et al. (2017) Degradation of PHLPP2 by KCTD17, via a Glucagon-dependent Pathway, Promotes Hepatic Steatosis. Gastroenterology 153, 1568-1580.
2. Chung, H. K., Ryu, D., Kim, K. S., Chang, J. Y., Kim, Y. K., Yi, H. S., et al. (2017) Growth differentiation factor 15 is a myomitokine governing systemic energy homeostasis. J Cell Biol 216, 149-65.
3. Ryu, D., Zhang, H., Ropelle, E. R., Sorrentino, V., Mazala, D. A., Mouchiroud, L., et al. (2016) NAD+ repletion improves muscle function in muscular dystrophy and counters global PARylation. Sci Transl Med 8, 361ra139.
4. Ryu, D., Mouchiroud, L., Andreux, P. A., Katsyuba, E., Moullan, N., Nicolet-Dit-Felix, A. A., et al. (2016) Urolithin A induces mitophagy and prolongs lifespan in C. elegans and increases muscle function in rodents. Nat Med 22, 879-88.
5. Zhang, H., Ryu, D., Wu, Y., Gariani, K., Wang, X., Luan, P., et al. (2016) NAD(+) repletion improves mitochondrial and stem cell function and enhances life span in mice. Science 352, 1436-43.
6. Sadhukhan, S., Liu, X., Ryu, D., Nelson, O. D., Stupinski, J. A., Li, Z., et al. (2016) Metabolomics-assisted proteomics identifies succinylation and SIRT5 as important regulators of cardiac function. Proc Natl Acad Sci USA 113, 4320-5.
7. Ryu, D., Jo, Y. S., Lo, Sasso G., Stein, S., Zhang, H., Perino, A., et al. (2014) A SIRT7-dependent acetylation switch of GABPbeta1 controls mitochondrial function. Cell Metab 20, 856-69.
첨부파일