
생화학분자생물학회입니다.
망막 질환 치료를 위한 신약 개발 연구
작성자
관리자작성일자
2016-12-01조회수
437망막 질환 치료를 위한 신약 개발 연구

김상진
성균관대학교 의과대학 삼성서울병원 안과
안과에서 망막을 전공한다는 것은 불과 10년 전만 해도 비인기 ‘3D’ 분야에 뛰어드는 것을 의미했다. 그 이유는 아마도 안과의 다른 분야에 비해 검사/진단의 어려움, 많은 응급 환자와 긴 수술 시간 등의 특징 외에도 치료 결과가 불량했기 때문이었던 것 같다. 망막 질환이 결국 실명을 초래하는 경우가 많았지만 번번한 약이 있는 것도 아니고 수술의 결과도 좋지 않은 경우가 상당해 실망스러운 치료 결과 앞에 절망에 빠진 환자를 매일 대하는 인생을 살기로 결정한다는 것은 의사로서 쉽지 않았을 것이다. 그렇지만 망막 질환에서 이와 같은 ‘막막한’ 분위기가 최근 10년 동안 빠르게 바뀌고 있으며 그 중심에는 항체 신약을 비롯한 망막 질환 치료제의 개발이 있다.
그 첫번째 장을 연 것은 VEGF(Vascular Endothelial Growth Factor) 억제제의 개발이다. VEGF는 물론 망막 질환 이전에 종양학 등에서 더 먼저 주목을 받고 약제 개발이 시도되었지만 아마도 망막 질환에서의 효과나 파급 효과가 가장 강한 것으로 생각한다. VEGF는 이전에는 Vascular Permeability Factor로 불렸으며 이후 Angiogenesis를 촉진하는 강력한 분비 단백질이라는 사실이 알려지며 이름이 바뀌게 되었다. 1989년에 Science에 이에 대한 내용이 발표되었는데 이로부터 5년 후 안과에서 역사적인 연구가 N Engl J Med에 발표되게 된다 (1, 2). 바로 당뇨망막병증 등 망막혈관질환 환자의 안구 내 액체(전방수, 유리체 등)에서 VEGF가 매우 높게 증가되어 있음이 밝혀진 것이다 (2). 당뇨망막병증이나 망막정맥폐쇄 질환의 경우 망막의 모세혈관이 막히게 되며 이로 인해 망막 조직의 상대적인 허혈(Ischemia) 상태가 발생하고 이는 VEGF 발현 증가로 이어지는데 과도한 VEGF는 망막의 부종이나 신생혈관 발생을 유발해 시기능에 악영향을 끼치게 된다. 이에 대한 첫 임상적 근거가 1994년 발표되고 이후 축적된 전임상/임상적 근거 등을 토대로 VEGF의 작용을 억제하는 치료법 개발이 다각도로 이루어졌으며 그 중VEGF에 대한 첫 항체 신약인 Ranibizumab (Monoclonal Antibody Fragment (Fab) Against VEGF-A) 의 임상시험 결과가 2006년 N Engl J Med에 발표되고 FDA 승인을 받으며 망막 질환 치료의 새로운 시대가 열리게 되었다 (3, 4). 이후 VEGF Receptor 1의 두 번째 Domain 과 VEGF Receptor 2의 세 번째Domain을 Fc에 접합시킨 Aflibercept가 개발되어 2011년에 승인을 받았으며 최근에는 중국에서 자체 개발한Conbercept (VEGF Receptor 1의 두 번째 Domain 과 VEGF Receptor 2의 세 번째 및 네 번째 Domain을 Fc에 접합시킨 구조)도 임상시험에 성공해 중국에서 먼저 출시되었다. 이러한 약제의 개발은 망막 질환의 상당 부분을 차지하는 신생혈관성 황반변성(Neovascular Age-Related Macular Degeneration), 당뇨망막병증(Diabetic Retinopathy), 망막정맥폐쇄(Retinal Vein Occlusion)에 동반된 망막 부종, 미숙아망막병증(Retinopathy of Prematurity) 등 혈관신생과 관련된 망막 질환에서 탁월한 효과를 보이고 있다. 근래에는 VEGF 뿐 아니라 PDGF (Platelet-Derived Growth Factor) 등 다른 표적을 이용한 약제의 개발도 임상시험을 거치는 등 활발히 진행되고 있다.
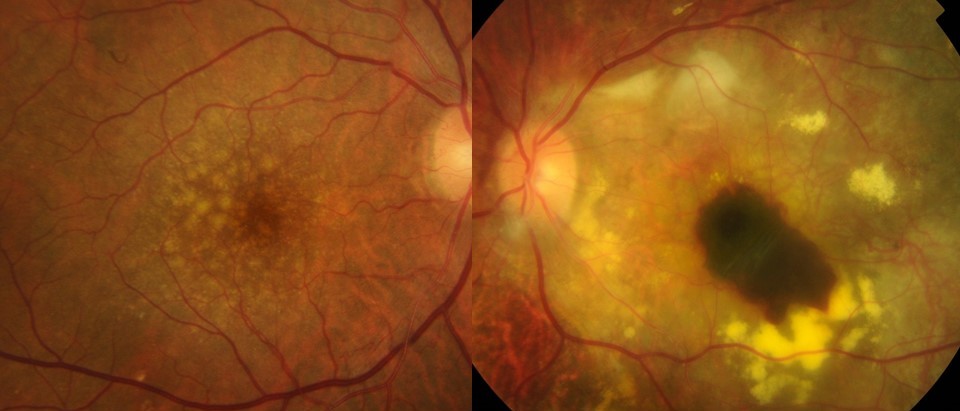
그림 1. (좌) 건성 황반변성 환자의 망막 사진. 중심부의 노란색 병변이 드루젠(Drusen)이라 불리는 망막하 침착물임. (우) 습성 황반변성 환자의 망막 사진. 출혈과 삼출물이 발생하여 환자는 심한 중심 시력 저하와 변형시를 호소하게 된다.
이들 중 대표적인 질환인 황반변성(Age-Related Macular Degeneration; AMD)은 현재 60세 이상 성인의 후천적 실명 원인 1위를 차지하는 질환으로 크게 건성(Dry Type ; Non-Exudative Type; Non-Neovascular Type)과 습성(Wet Type; Exudative Type; Neovascular Type)으로 구분된다. 보통 전체 황반변성에서 건성 대 습성의 비율은 9:1 정도이나 실명한 환자에서는 습성이 90% 정도를 차지하는 것으로 보고 있다. 국내 역학 조사 결과에서는 40세 이상 성인의 6.6%에서 황반변성이 나타났으며 그 중 습성 등 후기 황반변성이 10% 정도를 차지했다. 국내 발생률은 40세 이상 성인에서 연간 만명당 3명 정도로 추정되고 있다 (10). 황반변성은 처음에는 드루젠(Drusen)이라 불리는 침착물이 망막 아래, 망막색소상피(Retinal Pigment Epithelium) 층 아래에 침착되는 것으로 시작된다. 드루젠은 지질, 다당질, Glycosaminoglycan, 여러 단백질 등으로 구성되며 Amyloid-beta, Ig, C3, C5b-9 등 염증, 면역 반응 관련 인자들을 다수 포함하고 있다. 이러한 Drusen의 구성 성분들과, 유전학적 연구에서 CFH(Complement Factor H)의 변이 등 면역학적 인자의 변이가 황반변성과 밀접한 연관을 보인 점 등으로 황반변성에는 면역학적 기전이 관여하리라는 점이 알려짐에 따라 관련된 병인 연구가 활발히 진행되고 있다. 이에 따르면 노화와 지속된 Photo-Oxidative Stress가 망막색소상피의 탐식 작용을 저해시키고 Lipid Peroxidation이 발생해 TLR Signaling을 통해 망막색소상피의 손상이 진행되며 이는 Complement Pathway의 항진으로 인해 더 가속화된다. 또한 이는 Blood-Retinal Barrier의 파괴로 이어져 Macrophage 등 Peripheral Immune Cell Infiltration으로 IL-1beta, IL-6, TNF 등 Angiogenic Response가 증대되며 VEGF 등 혈관신생 인자가 과도하게 분비되어 맥락막 신생혈관, 망막 부종 등의 병리적 변화가 발생하게 된다. 이와 같은 병인이 점차 밝혀짐에 따라 각 Pathway를 억제시키는 치료제 개발도 함께 이루어 지고 있다.
국내에서도 이러한 약제 개발을 위한 연구가 다수 이루어지고 있으며 필자는 이러한 망막 질환 치료의 새로운 표적을 발굴하는 연구와 함께 개발된 약제 후보 물질의 전임상 연구를 수행하거나 개발 과정에 자문을 하는 일들을 함께 해오고 있다. 이러한 연구를 위해 필연적으로 질환동물모델을 제작하게 되는데, 습성황반변성 모델로는 맥락막신생혈관 모델, 망막하출혈 유발 모델 등을 제작, 사용하고 있으며 망막신생혈관 모델로는 산소유발망막병증 모델을 사용하고 있다 (5-8). 그 외 망막신경절세포 손상 모델, 약물유발 망막변성(광수용체 세포 손상) 모델 등을 제작하고 있다. 새로 개발한 망막 질환 후보 물질이 있을 경우 그 약제가 임상시험까지 연결되기 위해서는 여러 과정을 거쳐야 하는데, 성공을 위해서는 여러 분야의 전문가가 머리를 맞대고 적절한 연구 방법을 설계하고 전략을 모색해야 할 것이다. 이러한 과정에 Clinician Scientist가 적절한 역할을 하는 것이 특히 중요하다고 보지만, 국내에 이러한 역할을 수행할 수 있는 임상의사는 많지 않은 것 같다. 필자가 실험실 연구뿐 아니라 타 기관의 개발 과정에 자문을 하거나 공동 연구를 최대한 많이 하려는 것도 이러한 과정에 기여해 국내에서 망막 질환 신약이 탄생하길 간절히 바라기 때문이다.
대학, 연구소, 기업 등에서 새로 개발한 망막 질환 신약 후보 물질이 있을 경우 전임상 시험은 효능 시험, 안전성 시험, 약동학 시험 등으로 이루어진다. 망막 질환 신약 개발시에는 안구내 주사 등 투여 경로를 처음부터 염두에 두고 약제를 개발하게 되는데 안구내로 직접 투여하게 되면 전신적인 약리 작용을 최소화하면서 안구내 약제 농도를 높힐 수 있는 장점이 있다. 최근에 개발되고 있는 약들은 대부분 국소 투여를 목표로 제작되고 있다. 따라서 전임상 시험 단계에서는 안구내로 주입된 약의 안구내 안전성을 함께 평가해야 하는데 이는 안구내 염증 반응 유무, 망막의 기능적/조직학적 변화 여부 등이 특히 중요하다. 망막의 기능적 평가를 위해서는 망막전위도(Electroretinogram)가 흔히 사용되며 In Vitro에서 망막색소상피 등 안구 특이적인 세포를 이용한 독성 실험도 중요하다. 크기가 작은 안구의 특성상 주입할 수 있는 약제의 용량에 한계가 있고 실험 동물에서(특히 소동물에서) 안구내 반복 투여는 제한이 있기 때문에 In Vivo와 In Vitro 실험을 적절히 조합하는 것이 중요할 것으로 생각된다. 또한 신약이 항체인 경우 Species간 차이 때문에 영장류를 제외한 실험 동물에서는 효능 검증이 쉽지 않고 타약물과의 엄밀한 효능 비교도 사실상 불가능하기 때문에 개발 과정이 쉽지 않고 영장류 실험에 따른 비용 부담도 문제가 된다. 항체 외의 Chemical인 경우 안구내 주사시 작용시간이 짧을 가능성이 높으므로 Drug Delivery에 대한 고민이 필요할 것이다. 근래에는 Biodegradable Implant 등 Ocular Drug Delivery가 빠르게 발전하고 있기 때문에 다양한 방법을 시도해 볼 수 있을 것이다.
최근 망막 질환의 신약 개발 과정을 보고 있으면 국내에서도 충분히 좋은 Target을 발굴해 적절한 약제를 개발하고 임상시험을 거쳐 시장에 나오게 할 수 있을 것이란 생각이 저절로 든다. 뿐만 아니라 이미 많은 국내 연구자들이 이러한 연구를 진행 중이며 일부는 상당히 앞선 기술로 2-3년 내 임상시험에까지 진입할 수 있을 것으로 생각된다. 필자 역시 이러한 과정에 조금이라도 기여하고 싶은 마음이다.
참고문헌
1. Leung, D.W., Cachianes, G., Kuang, W.J., Goeddel, D.V., Ferrara, N. (1989) Vascular endothelial growth factor is a
secreted angiogenic mitogen. Science. 246(4935):1306-9.
2. Aiello, L.P., Avery, R.L., Arrigg, P.G., et al. (1994) Vascular endothelial growth factor in ocular fluid of
patients with diabetic retinopathy and other retinal disorders. N Engl J Med. 331(22):1480-7.
3. Rosenfeld, P.J., Brown, D.M., Heier, J.S., et al. (2006) MARINA Study Group. Ranibizumab for neovascular
age-related macular degeneration. N Engl J Med. 355(14):1419-31.
4. Brown, D.M., Kaiser, P.K., Michels, M., et al.; ANCHOR Study Group. (2006) Ranibizumab versus verteporfin for
neovascular age-related macular degeneration. N Engl J Med. 355(14):1432-44.
5. Kim, S.J., Lee, H.J., Yun, J.H., Ko, J.H., Choi, D.Y., Oh, J.Y. (2015) Intravitreal TSG-6 suppresses laser-induced
choroidal neovascularization by inhibiting CCR2+ monocyte recruitment. Sci Rep. 5:11872.
6. Kim, J., Kim, T.E., Kim, J.A., et al. (2014) Intravitreal Tanibirumab, a Fully Human Monoclonal Antibody
Against Vascular Endothelial Growth Factor Receptor 2, Partially Suppresses and Regresses Laser-Induced
Choroidal Neovascularization in a Rat Model. J Ocul Pharmacol Ther. 30:847-53.
7. Kim, S.J., Kim, J., Lee, J., et al. (2013) Intravitreal human complement factor H in a rat model of
laser-induced choroidal neovascularisation. Br J Ophthalmol. 97:367-70.
8. Kim, S.J., Ko, J.H., Yun, J.H., et al. (2013) Stanniocalcin-1 protects retinal ganglion cells by
inhibiting apoptosis and oxidative damage. Plos One 8:e63749.
9. Kim, S.J., Jin, J., Kim, Y.J., Kim, Y., Yu, H.G. (2012) Retinal Proteome Analysis in a Mouse Model of
Oxygen-Induced Retinopathy. J Proteome Res. 11:5186-203.
10. Park, S.J., Kwon, K.E., Choi, N.K., Park, K.H., Woo, S.J. (2015) Prevalence and Incidence of Exudative
Age-Related Macular Degeneration in South Korea: A Nationwide Population-Based Study.
Ophthalmology. 122(10):2063-70.
첨부파일