
생화학분자생물학회입니다.
항암 면역 치료법의 현재와 미래 (The Present and Future of Cancer Immunotherapy)
작성자
관리자작성일자
2016-12-01조회수
3106항암 면역 치료법의 현재와 미래
(The Present and Future of Cancer Immunotherapy)


김일규 강창율
서울대학교 약학대학 서울대학교 약학대학
royswit@gmail.com cykang@snu.ac.kr
1. 서론
면역 체계가 암을 억제할 수 있다는 생각이 1900년대 초 처음 제시된 이래 이에 대한 논쟁은 거의 100여 년 동안 지속되어 왔다. 그로부터 약 50년이 지난 후 암 항원의 존재가 밝혀지고, 면역학의 학문적 발전과 함께 암 면역이라는 개념이 생겨났지만 (1, 2) 그때까지도 완벽한 실험 시스템 부재로 인해 이를 뒷받침할 명확한 증거를 제시하지 못하는 상황이었다. 하지만, 1990년대 생명공학의 발전과 더불어 특정 유전자 타겟팅과 유전자 변형 마우스, 단클론 항체의 제조가 가능해짐에 따라 면역 체계가 전반에 걸쳐 암의 성장을 조절한다는 결과가 다수 보고되기 시작하였다 (3). 또한, 임상적으로도 암 조직 내 T 세포의 유입과 생존율의 관계가 보고되었고 (4), 면역 기능이 저하된 환자 및 노년층에서 암의 빈번한 발생이 유의미하게 밝혀지면서 (5, 6) 면역 체계와 암의 발생 간 상관 관계는 의심의 여지가 없어졌다. 암 면역학은 지속적인 연구를 통해 발전을 거듭하여 항암 면역 반응과 암 면역 억제 환경 사이의 밸런스에 의해 암의 발생이 조절될 수 있다는 개념을 정립하게 되었다 (7). 이는 면역 체계가 암 세포와 끊임없이 상호작용을 하며 암 성장을 저해할 수도 혹은 반대로 촉진할 수도 있음을 의미한다 (8). 유전적, 장내 미생총을 포함한 내부 환경 및 외부 환경적 요인, 만성 염증 반응 등 여러 가지 이유로 인해 이 밸런스가 깨지게 되면 암 세포는 항암 면역 반응을 회피하게 되며 성장, 발병하게 된다.
항암 면역 반응을 증진시키고 일부 암 면역 억제 환경을 극복하기 위한 일환으로 CTLA-4, PD-1과 같은 면역 관문(Checkpoint)을 저해하는 항체가 최근 항암제로서 임상 적용되었으며 그 결과 특정 암 환자에서 단독 투여만으로도 전반적 생존율 증가라는 대성공을 거두었다 (9, 10). 이에 항암 면역 치료법은 최근 5년 사이 가장 큰 관심을 받게 되었으며 본론에서는 면역 관문 저해 항체를 포함한 항암 면역 치료법의 종류 및 최신 연구 동향, 그리고 한계점 및 극복 방안을 논의해보고자 한다.
2. 본론
2-1. 항암 면역 치료법의 분류
기존의 암 치료법은 전통적인 외과적 절제 수술부터 방사선 요법이나 화학 요법이 주로 쓰이고 있으며 체내 면역 반응을 이용해 암을 치료하고자 하는 방법은 주류의 치료법은 아니었다. 그 사이 2000년대 초반 항체를 이용한 표적 항암제가 새로이 개발되었지만 약효 지속성과 빈번한 재발로 한계점을 보여 기존의 치료법을 대체하진 못하였다. 암 면역학이 발전함에 따라 방사선이나 화학 항암 제제 또한 면역 체계와의 공조를 통해 항암 효과를 낸다는 것이 알려졌지만 (11, 12) 이들을 항암 면역 치료법이라고 부르지는 않는다. 항암 면역 치료법은 암에 대응한 면역 반응을 증진시키거나 체내에 새로이 생성시키는 것을 직접적인 항암 기전으로 하는 치료법으로 작용 기전에 따라 수동적 면역 치료법(Passive Immunotherapy)과 능동적 면역 치료법(Active Immunotherapy)으로 분류될 수 있다 (7). 수동적 면역 치료법은 기존에 존재하는 면역 제재들을 암을 타겟으로 하여 추가적으로 체내 투여해주는 방식으로 사이토카인, 암 타겟 항체(예: HER2 mAb, Rituximab), 세포 독성 T 세포나 NK(Natural Killer) 세포 투여법이 이에 해당한다. 이에 반해, 능동적 면역 치료법은 체내 면역 세포를 타겟으로 그 기능을 증진시키거나 항암 작용을 새로이 유도하는 방식으로 면역 관문 저해 항체, 공자극 항체(Agonistic Costimulatory Antibody), 암 백신이 이에 해당할 수 있다 (그림 1). 항암 면역 치료법은 기존의 암 치료법과 달리 적은 부작용과 함께 뛰어난 치료 효과를, 궁극적으로 기억 면역(Immunological Memory) 반응을 통해 지속적으로 유도함으로써 암 완치를 목표로 한다고 할 수 있겠다.
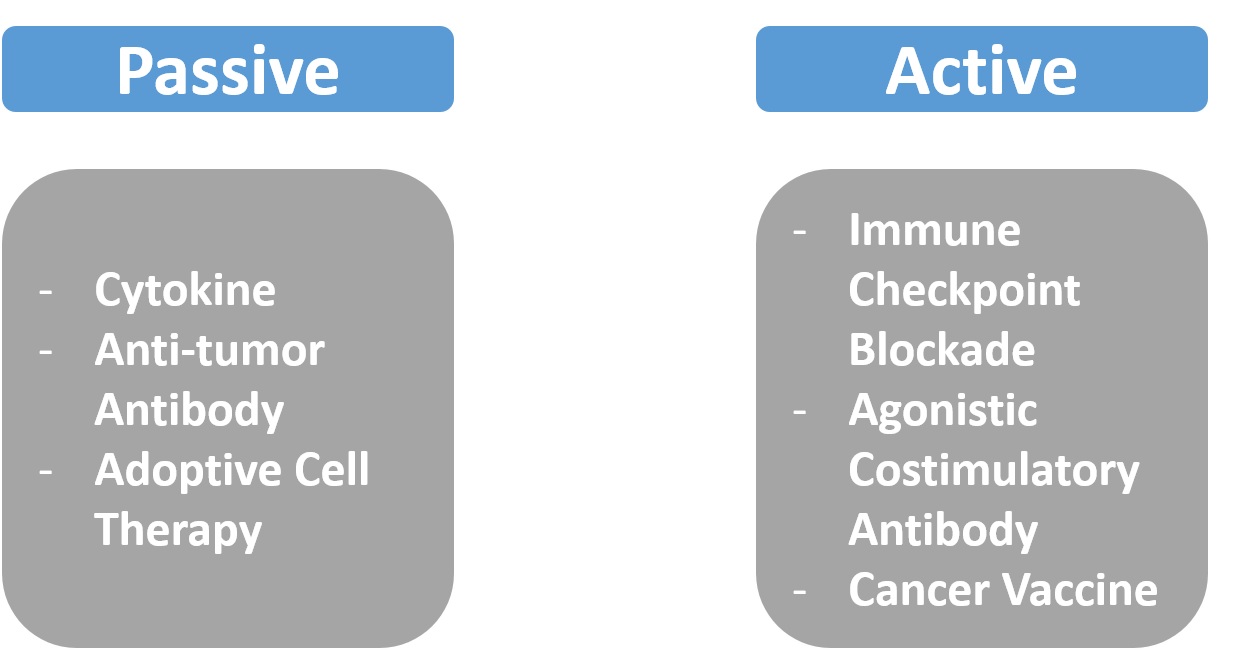
그림 1. 항암 면역 치료법의 분류
2-2. 항암 면역 치료법의 종류 및 연구 동향
T 세포는 항암 면역 반응에서 가장 중심적인 역할을 하며 임상적으로도 T 세포가 암을 조절할 수 있음을 보여주었다 (13). 따라서, 다음으로는 이러한 T 세포를 타겟으로 하여 항암 반응을 유도할 수 있는 면역 치료제들을 소개해보도록 하겠다.
1) 면역 관문 저해 항체 (Immune Checkpoint Blockade)
① CTLA-4 (Cytotoxic T Lymphocyte-Associated Antigen 4)
T 세포가 활성화되기 위해서는 항원을 적재한 항원 제시 세포(Antigen-Presenting Cell; APC)가 T 세포 수용체와 결합하여 하위 신호를 전달하여야 한다. 또한, 이 신호만으로는 T 세포가 충분히 활성화되지 못하며 추가적으로 T 세포의 CD28 분자와 그 리간드인 APC의 CD80(B7-1) 혹은 CD86(B7-2) 분자의 결합을 통한 신호 전달이 필요하다. CTLA-4는 T 세포가 활성화되면 발현이 증가하여 CD28 분자와 경쟁적으로 CD80 혹은 CD86 리간드를 공유함으로써 T 세포의 활성화를 억제하는 것이 알려졌다 (14). 이러한 현상은 과도한 면역 반응을 억제하여 조직을 보호하는 기능을 하기도 하지만 항암 면역 반응을 제한하는 요인이기도 하다. 또한, 면역 조절 T 세포(Regulatory T Cell; Treg)가 면역 억제 기능을 하는데 CTLA-4가 중요하다는 것이 알려진바 있다 (15). CTLA-4의 면역 억제 기능이 밝혀진 후 마우스 암 모델에서 CTLA-4 저해 항체의 항암 효과가 밝혀졌고 (16) 중개 연구로 인간 CTLA-4 저해 항체인 Ipilimumab이 처음 개발되어 암 환자에 사용되었다. 그 결과 2010년 처음으로 Ipilimumab이 후기 흑색종 환자를 대상으로 한 임상 3상에서 전체 생존율을 증가시키는 결과를 보여주었고 (9) 2011년에 전이 흑색종 환자에 대한 사용이 미국 FDA에 의해 허가되었다. 이는 후기 흑색종 임상 3상에서 환자의 생존율 증대 효과를 보인 전에 없던 첫 치료제로서 면역 관문 저해제가 후기 암 환자에게서 충분한 항암 효과를 오랫동안 나타낼 수 있다는 걸 보여준 혁신적인 결과였다. 이에 그치지 않고 신장암을 포함한 다른 암에의 적응 확대를 시도 중이며 새로운 CTLA-4 항체 Isoform인 Tremelimumab은 흑색종, 간암, 폐암, 대장암 환자에게서 임상 1~3상을 진행하고 있다 (표 1). 면역 관문 저해 항체는 기본적으로 암 특이적이지 않기 때문에 부작용이 일어날 수 있으며 CTLA-4 저해 항체에 대해서는 피부, 간 혹은 장에서 독성이 보고되었으나 이는 기존의 약물들로 제어가 가능한 수준이다.
② PD-1(Programmed Cell Death Protein 1) / PD-L1
PD-1은 APC와 암 세포에 발현되는 PD-L1(B7-H1)과 PD-L2(B7-DC)를 리간드로 하며 CTLA-4와 작용 기전은 조금 다르지만 결과적으로 T 세포 수용체의 신호 전달을 억제하여 T 세포의 활성화를 막는 역할을 한다 (17). PD-1은 유전자 클로닝부터 임상 적용, 미 FDA 승인까지 CTLA-4와 약 5년 간격을 두고 거의 동일하게 이루어졌다. 임상 항체는 Nivolumab과 Pembrolizumab으로 CTLA-4 저해 항체 Ipilimumab에 반응하지 않는 후기 흑색종 환자에게서도 보다 뛰어난 효과로 최대 40%까지 반응률을 보이며 2014년 FDA에 승인되었다. 또한, Nivolumab은 비소세포폐암 환자에게서도 생존율 증가 효과가 확인되어 2015년 FDA에 사용이 허가되었다. PD-L1은 많은 암 세포에서 선택적 발현이 보고되었고 (18) PD-1의 리간드로서 뿐만 아니라 CD80과도 결합하여 T 세포에 억제 신호를 전달할 수 있다. 이에 PD-L1 저해 항체도 많은 회사들이 개발하였으며 현재 다양한 암 환자에게서 임상 1~3상을 진행중이다 (표 1). 그리고, 암 세포의 PD-L1 발현은 PD-1 저해 항체의 임상 효과를 미리 확인할 수 있는 바이오마커로서 역할을 할 수 있으며 폐암, 난소암, 대장암 등에서 좋지 않은 예후와 연관성이 보고된 바 있다 (19). 하지만, PD-L1이 다양한 암에 대해서 범용적인 바이오마커로서 적절한지는 지속적인 연구가 필요한 실정이다. PD-1/PD-L1 저해 항체는 CTLA-4 저해 항체에 비해 폐렴 정도의 비교적 적은 부작용과 함께 보다 뛰어난 효과를 보여주어 앞으로 항암 면역 치료법의 Backbone이 될 것으로 예상되고 있다.
③ 그 외 면역 관문 타겟
LAG-3(Lymphocyte-Activation Gene 3)는 T 세포와 B 세포, 일부 APC에서 발현된다고 알려졌으며 T 세포의 LAG-3는 APC의 MHC II 분자와 결합하여 억제 신호를 전달한다. LAG-3는 PD-1과 함께 기능 저하 CD8 T 세포의 마커로서 연구가 많이 되어 있으며 마우스 암과 감염 모델에서 역할이 보고된 바 있다 (20). 임상적으로는 Soluble LAG-3 Fusion Protein이 신장암 임상 1상에서 테스트된 바 있고, 저해 항체가 임상 진행중이다 (표 1). 이외에도 기능 저하 CD8 T 세포의 잘 알려진 마커들인 TIM-3(T-Cell Membrane Protein 3)와 TIGIT(T-Cell Immunoreceptor with Ig and ITIM Domains), 그리고 BTLA(B- and T-Lymphocyte Attenuator) 등이 전임상 단계에서 효과를 보여주었다.
2) 공자극 항체
공자극 항체는 T 세포의 공자극 분자(Costimulatory Molecule)를 타겟으로 하는 항체로 면역 관문 저해 항체와는 달리 자극 항체를 사용하여 T 세포의 생존, 활성화, 분열 및 분화를 촉진하여 항암 효과를 유도한다. 현재 임상 진행 중인 공자극 항체 타겟들을 아래에 소개하도록 한다.
① CD40
CD40는 APC와 일부 암 세포에서 발현되며 T 세포의 CD40L와 결합하여 T 세포를 활성화시킬 수 있다. 수지상 세포(Dendritic Cell; DC)의 성숙과 IL-12 생성에 관여하며 B 세포가 생성하는 면역글로블린 타입 전환에 중요한 역할을 한다. 임상적으로는 췌장암에 대해 대식 세포 매개 항암 효과를 내는 것이 보고된 바 있다 (21)(표 1).
② 4-1BB(T-cell Antigen 4-1BB Homologue)
4-1BB는 T 세포와 NK 세포 등에 발현되며 DC의 4-1BBL와 결합하면 항 Apoptotic 경로가 활성화되고 분열이 촉진된다. 임상 항체로 개발된 Urelumab은 흑색종 환자에서 효능을 보였지만 간 독성으로 유예되었다 (표 1). NK 세포 활성화 기능을 활용하여 암 세포 타겟팅 항체와 병용하는 치료법이 개발 중에 있다.
③ OX40
T 세포에 발현된 OX40는 APC의 OX40L와 결합하여 기본적인 T 세포 활성화와 함께 타입 1, 2 도움 T 세포 반응을 유도하고 조절 T 세포의 기능은 억제한다. 이런 작용 원리를 기반으로 흑색종 및 신장암 임상 1상에서 효과를 보여주었으며 (22)(표 1), 더 좋은 효과를 위하여 다른 항체 항암제와 병용 투여법이 임상 시험 중이다.
④ GITR(Glucocorticoid-Induced TNFR-Related Protein)
GITR 또한 T 세포의 활성화 및 효과 T 세포로의 분화, 사이토카인 생성 및 조절 T 세포 아형 분화 억제에 관여하며, GITR 자극 항체는 여러 마우스 암 모델에서 항암 효과 및 암에 대응한 기억 면역 반응을 생성한다고 보고된 바 있다. 최근에는 GITR 자극 항체가 IL-9을 매개로 항암 효과를 낸다는 것이 밝혀졌다 (23). 현재 임상 항체가 흑색종 환자를 대상으로 1상을 진행 중이다 (표 1).

표 1. 항체 항암제의 종류와 임상 현황
3) T 세포 치료제(Adoptive T-cell Therapy)
암 특이적 T 세포가 암 조직으로 이동하여 암 항원을 마주하면 일시적으로 붙잡혀 조직 내 머무르게 되는데 이를 포함한 조직 일부를 절제하여 T 세포를 분리, T 세포 성장인자로 증식시켜 항암 세포 치료제로 사용하고자 하는 시도가 진행되었다. 하지만, 이러한 암 조직 내 유입 면역 세포(Tumor-Inflitrating Lymphocyte; TIL) 투여법은 전임상 결과와 달리 임상에서 실망스러운 결과를 보였다. 이는 아마도 분리한 TIL이 체내에서 계속된 자극에 항암 기능이 저하되었거나 혹은 투여한 암 환자 체내에 이미 면역 억제 환경이 갖추어져 있기 때문이라고 생각되었다. 이러한 문제점은 투여한 세포의 증식 및 지속성(Persistence)을 향상시키고 암 면역 억제 환경을 일부 제거할 수 있는 화학 요법과 병행했을 때 50%의 증가된 반응률을 보여줌으로써 일부 극복되었으나 외과적으로 절제할 수 있는 암에만 제한적인 적용이 가능한 한계점이 있었다.
이에 다음으로는 암 항원 특이적인 T 세포 수용체를 유전적으로 클로닝하여 만든 인간 T 세포를 투여하는 방법을 고안하였다. 이 때 중요한 점은 어떠한 암 항원에 특이적인 T 세포 수용체를 선택할 것인가 하는 점이었다. 그 중 암 세포에서 후성적(Epigenetic) 변화에 의해 생성되는 Cancer-Testis 항원(예: NY-ESO-1, MAGEA3, SSX2)은 일반 조직에선 발현을 하지 않는 항원으로, 이 항원에 특이적인 T 세포 수용체를 도입한 세포를 투여했을 때 부작용은 없으면서 흑색종 및 전이 육종암에 좋은 효과를 보여주었다 (24, 25).
하지만, 위 방법도 MHC II 분자 발현과 암 세포가 항원을 발현하느냐에 따라 특정 암에 제한적인 효과를 보여줬으며 이에 T 세포 수용체 세포 외 부분 대신 암 항원 특이적인 항체의 Variable Fragment로 치환한 카이메릭 항원 수용체(Chimeric Antigen Receptor; CAR) T 세포를 개발하였다. CD19를 타겟팅한 CAR T 세포는 특히 급성 B 림프모구성 백혈병(B-cell Acute Lymphoblastic Leukemia) 환자에게서 70~90%에 달하는 반응률과 생존율 증가 결과를 보여주었다. 최근에는 이 CAR T 세포에 암 면역 억제 환경을 극복하기 위해 IL-12, 4-1BBL 혹은 OX40L를 발현하는 것과 암 조직 내 유입을 개선시킨 것 등의 기능을 추가한 CAR T 세포들도 개발되었다 (26).
4) 암 백신(Cancer Vaccine)
백신은 항원과 아쥬반트(Adjuvant)로 구성되며 암 백신의 경우 암 항원의 선택과 전달 방식에 따라 다양하다. 암 항원의 경우 강한 면역원성을 지닌 부분을 선택하는 것이 중요하고, 아쥬반트는 대개 항원을 섭취, 제시하는 DC를 성숙 및 활성화시킬 수 있는 제제를 선택한다. 암 예방 백신으로는 HPV나 Hepatits B Virus와 같이 Virus가 암의 발생에 관여할 경우 해당 Virus 항원 백신이 효과를 보여주었다. 치료 백신은 Sipuleucel-T가 승인 받은 유일한 암 치료 백신이며 이는 대부분의 전립선 암이 발현하는 Prostatic Acid Phosphatase(PAP) 항원과 아쥬반트로서 GM-CSF를 시험관 내에서 적재 후 자가 면역세포에 재투여해주는 것으로 전립선 암 환자의 생존율 개선 효과를 보였다. 흑색종 항원인 gp100 백신과 IL-2 병용 투여가 임상 3상을 진행 중이며, GM-CSF를 발현하도록 유전적으로 개조한 암 세포 기반 백신인 GVAX는 다른 백신과 병용을 통해 췌장암에 일부 효능을 보여주었다. 항원 전달 방식에 따라 체외에서 직접 DC에 암 항원을 적재하거나 바이러스 벡터를 이용한 방식이 있으며 일부 임상 3상을 진행 중이다. 또한, 환자의 암에 특별한 mRNA 혹은 DNA를 기반으로 한 암 백신도 개발된 바 있다. 암 백신의 경우 반응은 비교적 느리지만 암 항원에 대한 확실한 기억 면역 반응을 유도해 항암 효과를 내는 것이 목표이고 그 과정에서 DC의 성숙, 활성화에 따른 항원 제시능이 중요하다고 할 수 있겠다 (7, 27). 최근에는 DC 대신 NKT 리간드와 암 항원을 적재한 B 세포와 monocyte 기반 백신이 국내 연구진에 의해 개발되었으며 (28) 현재 임상 진행중이다.
2-3. 암 면역 억제 환경과 단일 항암 면역 치료법의 한계점
암과 면역 체계는 끊임없이 상호 작용하며 암이 조직을 이루어 관찰될 정도가 되면 이미 암의 다양한 면역 회피 기전들이 활성화된 상태라고 볼 수 있다. 암은 i) 암 항원 발현 상실, ii) 만성 염증 환경, iii) T 세포의 유입 저해, iv) 암 환경에 의한 DC의 항원 제시능 저해, v) 면역 관문, 면역 억제 사이토카인 및 면역 억제 세포들로 구성된 암 면역 억제 환경들을 통해 항암 반응을 억제할 수 있다 (29). 특히 암이 생성한 면역 억제 환경은 항암 면역 치료법이 기대한 효과를 내는데 큰 걸림돌이 되고 있다 (그림 2). 또한, 암과 면역 억제 환경은 매우 Heterogenous하며 이외에도 암의 성장을 촉진하는 요인들이 다양하게 존재한다 (7). 이를 고려할 때 단일 항암 면역 치료법으로 암의 완치를 기대하는 것은 무리일 수 있으며 기존의 항암 제제들과 여러 항암 면역 치료법을 병용하는 것이 암을 효율적으로 치료하는 길임을 알 수 있다.
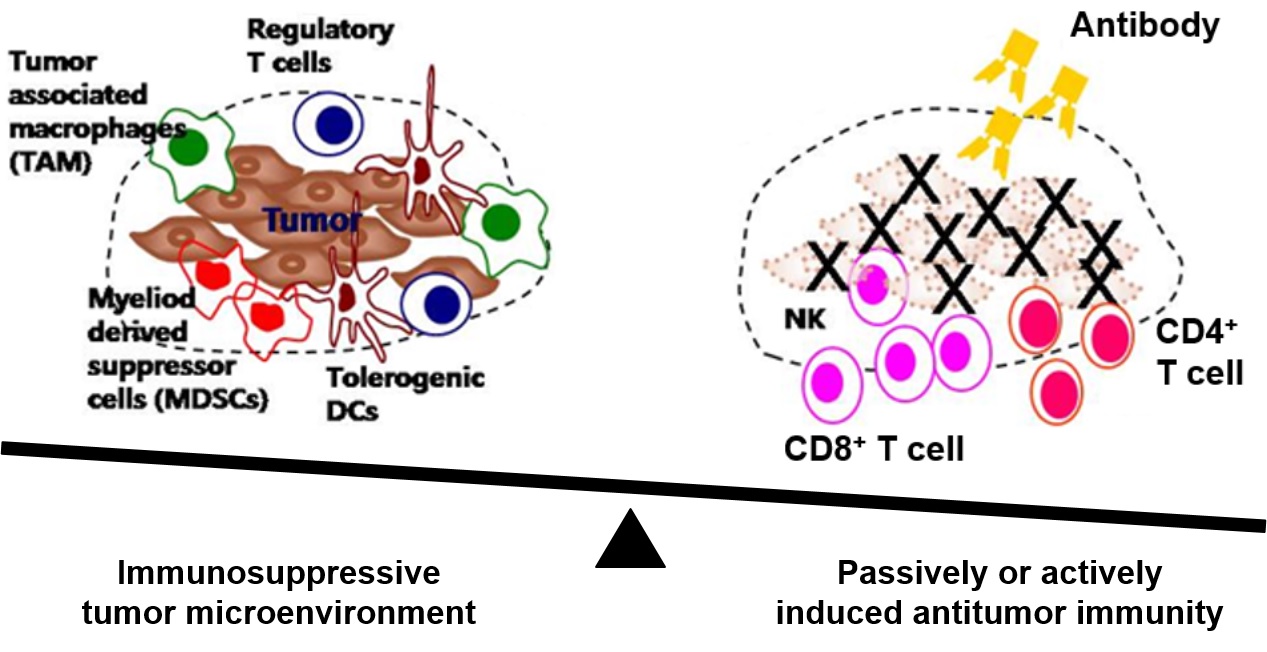
그림 2. 암 면역 억제 환경과 항암 면역 반응의 생성
2-4. 항암 면역 치료법의 미래
단일 항암 면역 치료법은 특정 암에서 뛰어난 효과를 보이기도 하지만 다른 종류의 암에서는 제한적인 효과를 보인다. 이를 극복하기 위해서는 서로 다른 타겟을 가지는 기존 항암제 및 여러 면역 치료법의 병용이 해답이 될 것이다. 그러면 다음 질문은 어떤 치료법들을 병행하여 사용할 것이냐 하는 것이다. 이를 위해선 치료 전 해당 암과 그 면역 환경을 평가할 필요가 있다. 이러한 시도는 이미 현재 이루어지고 있는데 여러 암 종류에 따라 변이에 의한 암 항원 생성 정도와 면역 억제 환경이 차이가 있다는 것을 보고한 바 있다. 이에 따르면 흑색종이나 비소세포폐암의 경우 변이에 의한 암 항원 생성이 다양한 반면 면역 억제 환경이 강하게 조성되어 이를 막는 면역 관문 저해 항체가 필수적이다. 이에 반해, 변이에 의한 암 항원 생성이 적은 경우는 T 세포 특이성이 없어도 되는 CAR T 세포 치료가 효율적이다라고 말하고 있다 (26). 또 다른 보고에서는 TIL 존재 유무와 암 세포의 PD-L1 발현 여부에 따라 암을 분류하고 적절한 면역 치료법을 선택할 수 있다고 제안하고 있다 (30). 하지만, 궁극적으로는 환자 각 개인마다 암 세포 시퀀싱을 통하여 적용할 면역 치료법을 선택하여야 할 것이며 이를 평가할 바이오마커의 정립이 필요할 것이다. 또한, 이렇게 선택한 치료법들은 각각 독성을 지니고 있기 때문에 합리적인 Risk/Benefit 기준으로 최적의 용량 및 Regimen 설정이 추가로 필요할 것이다.
3. 결론
면역 관문 저해 항체의 놀라운 임상 성과는 많은 학자와 임상의들의 면역 치료제에 대한 관심을 불러왔다. 좋은 성과를 내고 있는 면역 항암 치료제들은 암 세포를 직접적으로 타겟하기 보다 간접적으로 면역 체계에 작용하여 뛰어난 효과를 지속적으로 보여준다. 본문에 소개된 여러 면역 치료법과 이외 지면상 이유로 소개되지 않은 면역 치료법, 그리고 기존 항암제와 다른 분야에서 개발된 항암 치료법은 서로 보완적인 효과를 가지고 있을 것이다. 암 환자를 개인별로 평가하고 이에 효과적인 병용 치료법이 맞춤형으로 정립되어 있다면 암 정복도 꿈은 아닐 것이다.
참고문헌
1. Old, L.J. and Boyse, E.A. (1964) Immunology of Experimental Tumors. Annu Rev Med 15, 167-186
2. Burnet, F.M. (1970) The concept of immunological surveillance. Prog Exp Tumor Res 13, 1-27
surveillance system in immunocompetent mice. Proc Natl Acad Sci U S A 95, 7556-7561
epithelial ovarian cancer. N Engl J Med 348, 203-213
United States. Am J Transplant 4, 905-913
and age-related degenerative disease? Semin Cancer Biol 21, 354-359
7. Palucka, A.K. and Coussens, L.M. (2016) The Basis of Oncoimmunology. Cell 164, 1233-1247
suppression and promotion. Science 331, 1565-1570
metastatic melanoma. N Engl J Med 363, 711-723
N Engl J Med 372, 320-330
immune system to anticancer chemotherapy and radiotherapy. Nat Med 13, 1050-1059
and the Impact of Radiation on Immune Activation. Front Oncol 6, 141
J Clin Oncol 33, 1974-1982
stimulation. J Exp Med 182, 459-465
Science 322, 271-275
Science 271, 1734-1736
by blocking the TCR-induced stop signal. Nat Immunol 10, 1185-1192
mechanism of immune evasion. Nat Med 8, 793-800
19. Okazaki, T. and Honjo, T. (2007) PD-1 and PD-1 ligands: from discovery to clinical application.
Int Immunol 19, 813-824
regulate T-cell function to promote tumoral immune escape. Cancer Res 72, 917-927
against pancreatic carcinoma in mice and humans. Science 331, 1612-1616
late-stage cancer patients. Cancer Res 73, 7189-7198
protein co-stimulation facilitates tumor regression by inducing IL-9-producing helper T cells.
Nat Med 21, 1010-1017
against NY-ESO-1. N Engl J Med 358, 2698-2703
cell sarcoma and melanoma using genetically engineered lymphocytes reactive with NY-ESO-1.
J Clin Oncol 29, 917-924
immunomodulation, CARs and combination immunotherapy. Nat Rev Clin Oncol 13, 273-290
Cancer Discov 6, 703-713
cytotoxic antitumor immunity in vivo. Cancer Res 66, 6843-6850
immunosubversion. Nat Rev Immunol 6, 715-727
tumour microenvironment. Nat Rev Clin Oncol 13, 143-158
첨부파일