
생화학분자생물학회입니다.
Neurogenetics and Ribonomics Laboratory
작성자
관리자작성일자
2016-11-01조회수
439Neurogenetics and Ribonomics Laboratory
임정훈
UNIST 생명과학부
[연구실소개]
인간을 포함한 동물들의 다양한 행동은 고차원적 뇌기능의 결과물로써, 그 조절 기전의 분자신경생물학적 규명과 관련 뇌기능 장애에 관한 연구는 신경과학에 있어 가장 흥미롭고 중요한 연구분야 가운데 하나입니다. 본 연구실은 현상학적으로 복잡해보이는 동물의 행동이 특정 신경회로에서 작용하는 주요 조절 유전자들에 의해 어떻게 예측 가능한 방식으로 제어되는지, 그 근본적인 질문에 대한 답을 찾기 위한 연구를 수행하고 있습니다. 이를 위해 진화적으로 잘 보존되어 있으며 생리학적으로 매우 중요한 생체 리듬과 수면 행동의 초파리 모델을 활용하여, 이들 행동 제어에 필수적인 신경회로와 유전자를 규명하고 그 작용 기전을 분자 수준에서 이해하기 위해 행동유전학, 신경세포 특이적 유전자 발현 분석과 신경세포 활성의 기능적 이미징, 분자세포생물학, 생화학 등 매우 포괄적인 실험적 접근법을 사용하고 있습니다. 최근에는 루게릭병과 같은 퇴행성뇌질환의 발병에 중요한 위험 유전자인 Ataxin-2가 특정 생체시계 유전자의 RNA와 결합하여 전사 후 유전자 발현을 촉진하는 공활성화 인자로 작용함으로써 24시간 주기의 생체리듬을 유지한다는 새로운 분자생물학적 기능을 밝힌바 있습니다. 현재 본 실험실에서는 Ataxin-2에 의한 퇴행성 뇌질환 발병 기작과 생체리듬 조절에 있어 새로운 전사 후 유전자 발현 조절 인자의 역할 규명, 그리고 좀 더 포괄적인 의미에서 수면 항상성을 정의하고 이를 조절하는 새로운 신경유전학적 원리를 규명하기 위해 다음과 같은 연구가 진행되고 있습니다.
[연구내용]
1. Ataxin-2 단백질 복합체의 전사 후 유전자 발현 조절과 생리학적 기능 규명
RNA결합 단백질에 의한 전사 후 유전자 발현 조절은 비대칭적인 신경세포 구조를 통한 신경세포 신호전달체계의 시공간적 제어 뿐만 아니라, 신경 회로의 발생과 분화 등 매우 다양하고 복잡한 신경세포 특이적 생리작용에 있어 매우 중요한 유전자 발현 기전으로 진화해 왔습니다. 유전적 돌연변이에 의한 RNA결합 단백질과 그 표적 유전자의 비정상적인 기능이 다양한 뇌질환의 병리학적 원인으로 작용한다는 사실은 이러한 RNA결합 단백질의 진화 모델을 매우 구체적으로 뒷받침하고 있습니다.
본 실험실에서는 행동유전학적 유전자 탐색을 통해 전사 후 유전자 발현 조절과 일주기성 생체리듬의 제어에 중요한 Ataxin-2 단백질 복합체를 동정하였고, 이를 구성하는 새로운 RNA 결합 단백질의 기능을 규명하고 있습니다 (그림 1). Lsm12는 본 연구팀에 의해 새롭게 동정된 Ataxin-2 단백질 복합체 구성 단백질 가운데 하나로, Ataxin-2단백질이 특정 표적 단백질과 결합하여 단백질 복합체를 형성하는데 필수적인 분자어댑터로 작용하여 표적 단백질의 번역 활성 기능을 촉진하는데 필수적으로 작용합니다. 이와는 대조적으로, RNA Helicase 기능을 가지고 있는me31B/DDX6가 Ataxin-2와 함께 작용할 경우 RNA분해와 번역 억제에 관여하는 특정한 RNA결합 단백질의 기능을 활성화 시킴으로써 RNA의 안정성을 약화시키고 번역 억제 기능을 수행한다는 새로운 작용 기전도 본 연구진에 의해 밝혀졌습니다. 이러한 결과는 Ataxin-2 단백질이 어떠한 결합 단백질과 함께 복합체를 형성하느냐에 따라서 특정 RNA의 전사 후 유전자 발현을 촉진하거나 억제할 수 있다는 가능성을 시사합니다. 따라서 현재 본 실험실은 이러한 모델을 근거로 Ataxin-2와 그 결합 단백질의 작용 모델이 루게릭 병을 포함한 Ataxin-2 의존적인 퇴행성 뇌질환 모델의 발병에 있어 어떻게 기여를 할 것인지에 관한 후속 연구를 진행 중에 있습니다.
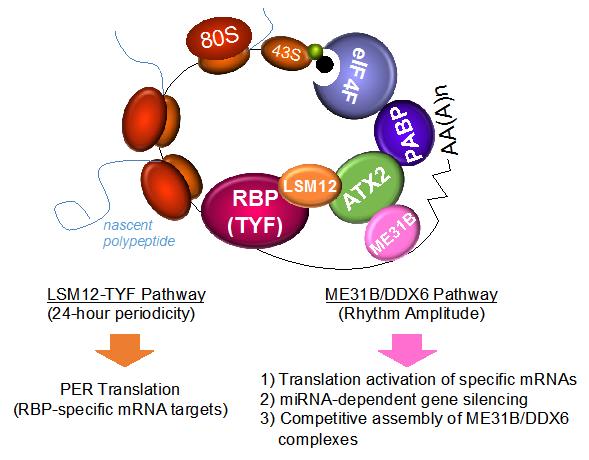
그림 1. Ataxin-2 단백질 복합체에 의한 전사 후 유전자 발현의 두 가지 조절 모델
2. 수면 항상성을 조절하는 신경유전학적 회로 규명
수면 항상성은 매일 일정한 양과 질의 수면을 유지하기 위해 각 개인의 수면 상태에 따라 수면 욕구를 조절하는 생리현상으로 생체 시계와 더불어 수면 조절의 필수적인 요소로 제시되어 왔습니다 (그림 2). 하지만 각 개인마다 다른 수면 양은 어떻게 결정되는지, 수면부족은 우리 뇌 속에서 어떻게 정량적으로 인지되는지, 외부 환경과 수면 상태에 따른 수면 욕구의 가역적 조절은 어떠한 형태로 이루어지는지 등 수면 현상에 대한 근본적인 이해가 부족한 실정입니다.
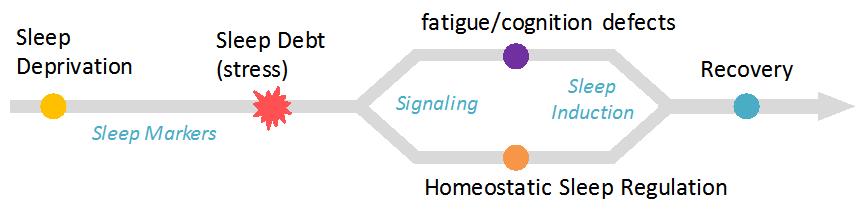
그림 2. 수면 결핍에 따른 항상성 수면 조절 작용 모델
본 실험실은 개체 수준에서 뇌기능의 유전학적 엔지니어링이 자유자재로 가능한 형질전환 초파리의 수면 모델을 활용하여 수면 조절의 분자신경생물학적 작용 기전에 관한 연구를 진행중에 있습니다. 수면 항상성을 통상적인 개념보다 광범위하게 적용함으로써, 불면증을 유전학적으로 모델링하는 수면장애 동물 모델과 환경적 요인에 따른 수면 행동의 변화를 통해 수면 항상성을 유도하고 이러한 수면 가소성에 중요한 새로운 수면 항상성 조절 유전자와 신경세포 회로, 신경전달 물질의 상호 조절 경로를 동정하여 검증하고 있습니다. 이러한 연구결과는 수면장애 치료 기술개발에 필요한 근본적인 수면 조절의 작동원리를 확립하고, 수면과 관련된 다양한 뇌기능의 조절과 뇌질환의 상호작용을 이해하는데 도움을 줄 것으로 기대하고 있습니다.
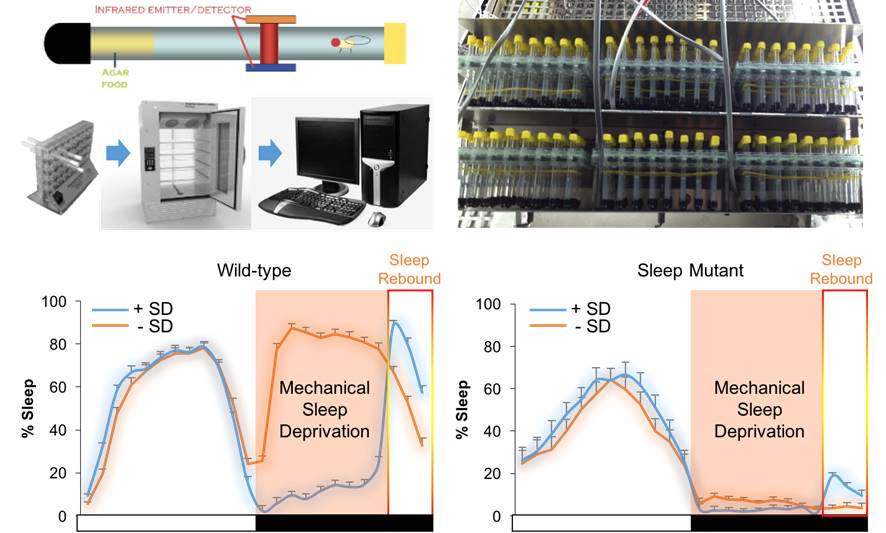
그림 3. 물리적 자극을 통한 수면 저해에 의해 유도된 수면 항상성 조절의 정량적 분석
[연구책임자]

임정훈 교수
주소: 울산광역시 울주군 언양읍 유니스트길 50
UNIST 생명과학부
전화: 052-217-2554
팩스: 052-217-2639
E-mail: clim@unist.ac.kr
Homepage: https://sites.google.com/site/neurogeneticsribonomicslab/
[연구진구성]
교수: 임정훈
석박사 통합과정: 이종보, 이호연, 유은석, 기윤희
학사과정: 김지형, 김민종, 김현진, 이병은, Aslan Kuan
Lab Manager: 허문성

[대표논문]
1. Kim, M., Lee, H., Hur, J-H., Choe, J., and Lim, C. (2016) CRTC Potentiates Light-independent timeless
Transcription to Sustain Circadian Rhythms in Drosophila. Scientific Reports 6, 32113.
2. Ki, Y., Ri, H., Lee, H., Yoo, E., Choe, J., and Lim, C. (2015) Warming up your tick-tock: temperature-dependent
regulation of circadian clocks. Neuroscientist 21, 503-518.
3. Lim, C. and Allada, R. (2013) Emerging roles for post-transcriptional regulation in circadian clocks.
Nature Neuroscience 16, 1544-1550.
4. Lim, C and Allada, R. (2013) ATAXIN-2 activates PERIOD translation to sustain circadian rhythms in Drosophila.
Science 340, 875-879.
5. Lim, C., Lee, J., Choi, C., Kilman, V.L., Kim, J., Park, S.M., Jang, S.K., Allada, R., and Choe, J. (2011) '
The novel gene twenty-four defines a critical translational step in the Drosophila clock. Nature 470, 399-403.