
생화학분자생물학회입니다.
장내 담즙산 신호체계 활성화를 이용한 새로운 대사질환 치료전략 개발
작성자
관리자작성일자
2015-12-01조회수
649장내 담즙산 신호체계 활성화를 이용한 새로운 대사질환 치료전략 개발

황성순
세종대학교 생명과학대학 바이오융합전공
서론
당뇨병은 췌장이 충분한 인슐린을 만들어내지 못하거나, 혹은 체내의 세포들이 인슐린에 적절한 반응을 하지 못할 때 발생하는 질병으로 심혈관질환, 뇌졸중, 만성신부전, 당뇨병성 궤양 등의 심각한 합병증을 동반한다. 1970년대 대한민국 국민의 당뇨병 환자수는 약 1.5% 정도로 추정되었으나 최근에는 전 국민의 약 27% 정도로 추정하고 있으며, 총 당뇨병 환자수는 약 400만명에 육박하고 있다. 특히 최근에 급증하는 우리나라 당뇨병 환자들은 대부분 제2형 당뇨병으로 서구화된 식습관 및 운동부족으로 인한 비만, 그리고 그로 인한 인슐린 저항성에 의하여 발병한 것으로 보고되고 있으며 특히 당뇨병 전단계인 공복혈당장애 유병률은 무려 600만명에 달하는 등, 현재 대한민국의 인구 1000만명이 당뇨병 혹은 당뇨잠재군에 속한다고 알려져 있다. 2012년 보고에 따르면 당뇨병이 차지하는 사회 경제적 비용은 약 2조 7748억원으로 대한민국 사망원인의 5위안에 들어가는 만성질환이며, 급속한 인구의 고령화에 따른 영향으로 당뇨병은 매우 가파른 환자발생 증가율을 보고 있다. 특히, 최근에는 젊은층에서도 당뇨병 환자수가 눈에 띄게 증가하고 있으나 이에 따른 사회적 경제적 비용은 대부분 환자 및 가족이 부담하는 현실이며 따라서 당뇨병으로 인한 사회적 경제적 비용은 결국 우리나라의 의료, 사회보장 시스템을 위협할 것으로 보인다.
본론
핵수용체 FXR
핵수용체 Farnesoid X Receptor(FXR)은 담즙산과 결합하여 활성화되며 다양한 Target 유전자의 발현을 조절한다. FXR은 다양한 생리기전을 조절하는 핵심 단백질로서 Hepatic Gluconeogenesis, Lipogenesis 및 체내의 담즙산 신호체계의 항상성을 유지한다. 당뇨병이 진행될 경우, 각 조직에서 FXR의 발현이 현저히 줄어든다는 연구결과가 발표됨에 따라 FXR과 당뇨병의 연관성에 대하여 연구하기 시작하였다.
Farnesoid X Receptor(FXR)은 담즙산에 의해 활성화되는 대표적인 핵수용체이며 Cholesterol/Bile Acid Metabolism, Glucose/Lipid Metabolism, Hepatic Regeneration 및 장내에서의 Bacterial Population을 조절하는 등 다양한 생리적 현상을 조절한다 (1). 가장 잘 알려진 FXR의 기능은 간에서의 Cholesterol/Bile Acid Synthesis의 조절하는 기전이다. Cholesterol 이 Bile Acid로 간에서 분해가 될 때, Detergent 성질을 갖고 있는 Bile Acid가 간에 쌓일 경우 간세포에 손상을 일으키는데 FXR은 담즙산에 의해 활성화되어 Cholesterol을 Bile Acid로 변환하는 효소인 Cyp7a1의 발현을 억제한다. 담즙산은 FXR을 활성화시킴으로써 Negative Feedback의 원리로 Cholesterol/Bile Acid Synthesis를 조절, 간세포 내의 Cholesterol과 Bile Acid의 균형을 조절하게 된다 (그림 1).
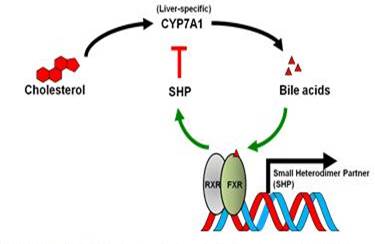
그림 1. 간에서 Cholesterol/Bile Acid Synthesis를 조절하는 FXR의 기전
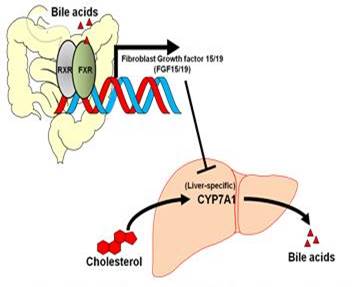
그림 2. 장에 존재하는 FXR에 의하여 Hepatic Bile Acid Synthesis가 조절되는 기전
담즙산의 Entero-Hepatic Homeostasis를 유지하는 것은 장내에 존재하는 FXR의 활성화를 조절하는 측면에서도 매우 중요하다. 담즙산의 항상성이 깨질 경우, Cholestasis와 같은 간질환이 일어날 가능성이 있으며 특히 장내에 존재하는 FXR의 활성은 FGF15/19 등의 Gene Expression을 조절하여 Cholesterol/Bile Acid Synthesis를 조절할 수 있고, 특히 Antimicrobial Peptide 등의 유전자발현, 혹은 장내의 Mucosal Defense Gene Expression을 조절한다 (3). 따라서 담즙산의 항상성을 통해 장내에 존재하는 FXR의 활성을 조절하는 것은 장내의 항상성유지에 매우 중요하다. 특히 장내 미생물군집이 대사량을 조절하여 비만을 조절한다는 것은 매우 잘 알려져 있다. 따라서 장내에 존재하는 FXR이 장내 미생물군집을 조절한다는 역할은 결국 담즙산의 Entero-Hepatic Homeostasis가 비만을 비롯한 대사질환과 밀접한 관련이 있다고 예상하고 있으나 정확한 기전은 알려져 있지 않고 있다 (그림 3).
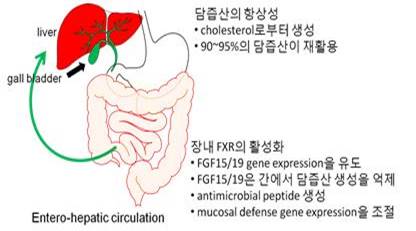
그림 3. Bile Acid Homeostasis를 유지하는 FXR의 중요성
FXR과 대사질환의 연관성
FXR-Deficient Mice에서 혈당 및 혈중 지질농도가 상승하고 인슐린 저항성이 나타난다고 보고됨에 따라, FXR이 비만/당뇨와의 연관성이 유추되었다 (4). FXR은 간에서의 Hepatic Gluconeogenesis 및 Lipogenesis에 관련된 유전자발현을 조절함으로써, 혈당 및 혈중 지질농도를 조절하는 능력이 있으며 FXR의 대표적인 활성물질인 GW4064를 일주일 가량 투여한 쥐에서 혈당감소, 혈중 지질농도가 감소되는 등 대사질환에 관련된 지표가 향상되는 것으로 드러났다 (5). 또한 비만 동물모델에서 Vertical Sleeve Gastrectomy(VSG)를 시도하였을 경우, 정상적인 비만쥐에서는 VSG에 의해 체중감소, 혈당 및 혈중 지질농도 감소가 나타났으나 FXR을 제거한 비만쥐에서 VSG를 시도하였을 경우, 수술에 따른 유의미한 체중감소 혹은 혈당 및 혈중 지질농도 감소가 나타나지 않았다는 연구 결과가 보고되었다. 일련의 연구결과에 따라 FXR이 체내의 대사조절 및 혈당조절에 매우 중요한 역할을 담당한다는 사실이 증명되었다 (6).
장내 FXR 활성화의 대사질환 치료전략으로서의 가능성
FXR의 기능을 활성화시키는 것이 당뇨병을 치료할 수 있는 새로운 Therapeutic Strategy가 될 것이라 여겨져 왔으나 GW4064를 장기간 투여할 경우, 기존 결과와는 달리 비만동물모델에서 더욱 심각한 비만을 유도하고 혈중 지질농도 및 혈당을 심대하게 증가시키는 등 여러 가지 부작용이 보고되었다 (7). 다양한 조직에서 FXR이 발현됨에 따라, 기존의 활성물질이 여러 조직에서 장기간 동안 FXR을 활성화할 경우 오히려 부작용을 일으킨 것이라는 주장이 설득력을 얻고 있으며 현재까지 비만동물모델에서 FXR의 기능을 장기적으로 활성화시킬 경우 심각한 대사질환이 일어나는 정확한 기전은 아직 밝혀지지 않았다. 따라서 이러한 모순점을 해결하기 위하여 기존에 알려진 활성물질의 부작용을 최소화할 수 있는 새로운 FXR 활성물질의 개발이 필요하며, 새로운 FXR 활성물질의 개발을 위해서는 각 조직에서의 FXR의 기능 및 생리학적 역할에 대한 자세한 연구가 필요하게 되었다.
최근 본인의 연구결과에 따르면 FXR의 Synthetic Ligand인 Fexaramine은 장내에만 작용하여 장내에 존재하는 FXR을 활성화시키며 장내에 존재하는 FXR이 활성화될 경우 갈색지방의 활성화 및 백색지방의 Browning을 촉진하여 대사량을 증가시킴으로써 비만을 억제할 수 있다는 결과가 발표하였다 (8). 이 연구에서 본인은 Fexaramine이라 불리우는 Small Molecule을 쥐의 구강으로 투여할 경우, 장내 투과성이 현저하게 낮음에 따라 장내에만 머무르면서 장내에 존재하는 FXR을 활성화시킨다는 사실을 발견하였다. 특히 구강투여에 따라 Fexaramine이 장내에 머무르면서 FXR을 활성화하였을 경우, Brown Fat에서의 Thermogenesis 및 Energy Expenditure가 활발하게 일어남에 따라 고지방식을 먹은 쥐에서 몸무게 증가가 현저히 감소하는 것을 확인할 수 있었다. 특히 White Fat Tissue에서 Energy Expenditure를 증가시킬 수 있는 Browning이 활발하게 증가하는 것을 관찰할 수 있었는데, 이와같이 Brown Fat의 기능 강화 및 White Fat의 Browning 증가에 따라 대사량이 증가함으로써 몸무게의 증가가 현저히 감소된 것으로 보인다.
대사량 증가에 따른 몸무게 감소와 더불어 Fexaramine을 구강으로 투여할 경우 간에서의 Gluconeogenesis 및 Lipogenesis를 억제하여 지방간이 줄어드는 것 역시 관찰할 수 있었다. 또한 지방간이 줄어듦에 따라, Liver Damage Marker로 사용되는 ALT 수치 역시 Fexaramine을 구강으로 투여할 경우 감소하는 것을 확인할 수 있었다 (그림 4).
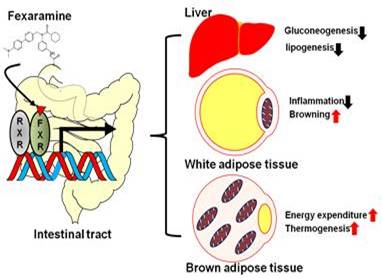
그림 4. 장내 FXR 활성화의 생리학적 기능 모식도
결론
이와 같은 연구결과를 바탕으로 장내에 존재하는 FXR의 기능이 대사질환에 미치는 중요성을 알 수 있었다. 음식을 섭취하였을 때 분비되는 담즙산이 장내에 존재하는 FXR을 활성화시킨다는 사실을 고려할 때, Fexaramine과 같은 Small Molecule을 사용하여 음식물을 섭취했을 때 수반되는 담즙산 신호체계를 모방하는 방법은 비만 등과 같은 대사질환을 치료할 수 있는 가능성을 제시할 수 있다. 또한 당뇨병은 비만 등과 같은 대사질환과 떼어놓을 수 없는 매우 유사한 대사질환이므로 Fexaramine 등과 같이 장내에 존재하는 FXR을 활성화시키는 Small Molecule이 당뇨병을 비롯한 대사질환을 치료할 수 있는 가능성 역시 존재한다고 여겨진다.
참고문헌
| 1. | Lee, F.Y., Lee, H., Hubbert, M.L., Edwards, P.A., Zhang, Y. (2006) FXR, a multipurpose nuclear receptor. Trends Biochem Sci 31(10):572-80. |
| 2. | Inagaki, T., Choi, M., Moschetta, A., Peng, L., Cummins, C.L., McDonald, J.G., Luo, G., Jones, S.A., Goodwin, B., Richardson, J.A., Gerard, R.D., Repa, J.J., Mangelsdorf, D.J., Kliewer, S.A. (2005) Fibroblast growth factor 15 functions as an enteroHepatic signal to regulate bile acid homeostasis. Cell Metab 2(4):217-25. |
| 3. | Inagaki, T., Moschetta, A., Lee, Y.K., Peng, L., Zhao, G., Downes, M., Yu, R.T., Shelton, J.M., Richardson, J.A., Repa, J.J., Mangelsdorf, D.J., Kliewer, S.A. (2006) Regulation of antibacterial defense in the small ntestine by the nuclear bile acid receptor. Proc Natl Acad Sci USA 103(10):3920-5. |
| 4. | Sinal, C.J., Tohkin, M., Miyata, M., Ward, J.M., Lambert, G., Gonzalez, F.J. (2000) Targeted disruption of the nuclear receptor FXR/BAR impairs bile acid and lipid homeostasis. Cell 102(6):731-44. |
| 5. | Zhang, Y., Lee, F.Y., Barrera, G., Lee, H., Vales, C., Gonzalez, F.J., Willson, T.M., Edwards, P.A. (2006) Activation of the nuclear receptor FXR improves hyperglycemia and hyperlipidemia in diabetic mice. Proc Natl Acad Sci USA 103(4):1006-11. |
| 6. | Ryan, K.K., Tremaroli, V., Clemmensen, C., Kovatcheva-Datchary, P., Myronovych, A., Karns, R., Wilson-Perez, H.E., Sandoval, D.A., Kohli, R., Backhed, F., Seeley, R.J. (2014) FXR is a molecular target for the effects of vertical sleeve gastrectomy. Nature 509(7499):183-8. |
| 7. | Watanabe, M., Horai, Y., Houten, S.M., Morimoto, K., Sugizaki, T., Arita, E., Mataki, C., Sato, H., Tanigawara, Y., Schoonjans, K., Itoh, H., Auwerx, J. (2011) Lowering bile acid pool size with a Synthetic farnesoid X receptor (FXR) agonist induces obesity and diabetes through reduced energy expenditure. J Biol Chem 286(30):26913-20. |
| 8. | Fang, S., Suh, J.M., Reilly, S.M., Yu, E., Osborn, O., Lackey, D., Yoshihara, E., Perino, A., Jacinto, S., Lukasheva, Y., Atkins, A.R., Khvat, A., Schnabl, B., Yu, R.T., Brenner, D.A., Coulter, S., Liddle, C., Schoonjans, K., Olefsky, J.M,, Saltiel, A.R., Downes, M., Evans, R.M. (2015) Intestinal FXR agonism promotes adipose tissue browning and reduces obesity and insulin resistance. Nat Med 21(2):159-65. |
첨부파일