
생화학분자생물학회입니다.
콜레스테롤 대사기전, CH25H-CYP7B1-RORα axis에 의한 퇴행성관절염의 조절
작성자
관리자작성일자
2020-03-23조회수
1237콜레스테롤 대사기전, CH25H-CYP7B1-RORα axis에 의한 퇴행성관절염의 조절
The CH25H-CYP7B1-RORα axis of cholesterol metabolism regulates osteoarthritis
Nature 566, 254–258 (2019)




전장수 (광주과학기술원 생명과학부 교수, E-mail: jschun@gist.ac.kr)
류제황 (전남대학교 치의학전문대학원 교수, E-mail: jesryu@jnu.ac.kr)
연구배경
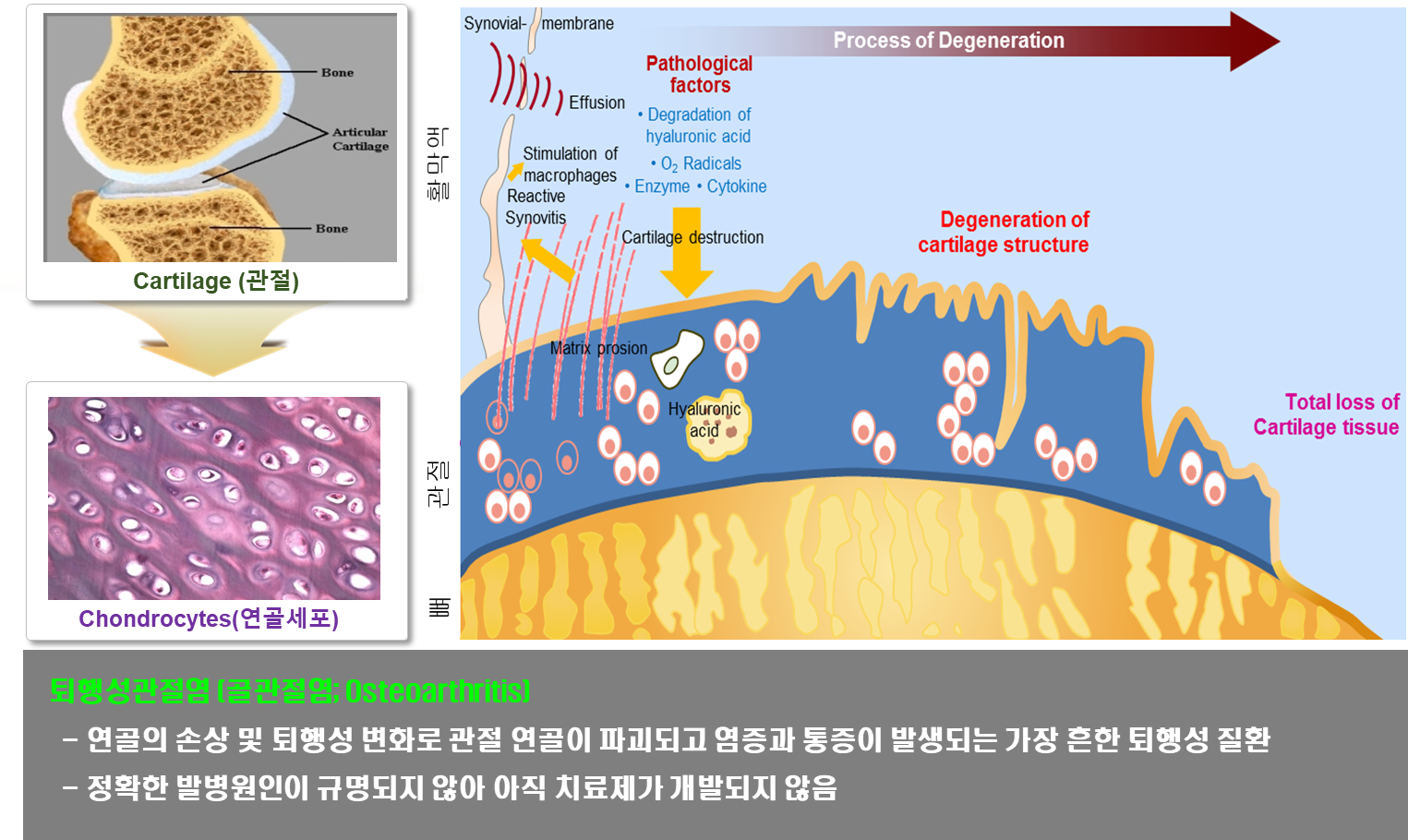
연골조직이 닳아 없어지는 퇴행성관절염은 점진적이고 비가역적으로 일어나 삶의 질을 떨어뜨리는 퇴행성 질환으로, 노령화의 급속한 진행과 함께 환자 수가 현저하게 증가하고 있다. 2018년 건강보험심사평가원이 발표한 자료에 따르면 2017년 무릎관절증 환자의 수는 297만여명에 달하며, 여성 환자 수가 남성보다 2배 이상 많으며 발병률은 나이가 들수록 높아진다(1). 퇴행성관절염의 치료를 위한 많은 연구에도 불구하고 병리적 원인이 불명확하고 근본적 치료방법이 개발되지 않고 있으며, 현재까지 수술적 방법 외에는 항염증제 등을 통한 통증완화 등에 그치고 있다. 또 연골보호제(히알루론산, 글루코사민, 콘드로이틴) 등이 개발되었으나 세포 및 조직의 퇴행억제와 연골생성촉진 및 재생유도 효과가 확립되지 않았다. 퇴행성관절염의 증상은 연골조직의 손상 (Cartilage destruction), 연골조직 아래 위치하는 연골하골의 비후화 (Subchondral bone thickening), 손상된 연골조직 근처에 생성되는 비정상적 골조직인 골극의 형성 (Osteophyte formation) 등이며 심한 통증과 관절 가동범위의 축소가 함께 동반된다(2). 퇴행성관절염은 오랫동안 연골의 기계적 손상과 마모로 인해 나타나는 질환으로 여겨져 왔지만, 십년 사이에 HIF-2α, ZIP8 (Zinc transporter)-MTF axis 등과 같은 퇴행성관절염의 다양한 분자적 조절기전이 규명되었다(3, 4). 최근 들어서 비만, 고혈압, 당뇨, 이상지질혈증 같은 대사성 증후군 (metabolic syndrome)과 퇴행성관절염 사이의 연관성이 밝혀지기 시작하고 있다(5). 특히 최근들어 몇몇 연구그룹에서 콜레스테롤과 퇴행성관절염 사이의 연관성을 암시하는 연구결과가 발표된 바 있다(6–10). 그러나 퇴행연골세포 내 콜레스테롤의 축적이 어떠한 방식으로 일어나는지, 축적된 콜레스테롤이 어떠한 방식으로 대사되는지, 그리고 축적된 콜레스테롤과 콜레스테롤 대사체가 어떻게 연골퇴행을 유도하는지에 대해 구체적으로 밝혀지지 않았다.
연구결과
1. 퇴행성관절염 연골세포에서 LOX1에 의한 oxLDL 유입에 따른 콜레스테롤 농도증가 관찰
퇴행성관절염을 유도하는 것으로 알려진 염증성 사이토카인 IL-1β, TNF-α을 처리하거나, 본 연구진의 선행연구를 통해 규명한 퇴행성관절염 유도인자인 HIF-2α, ZIP8을 과발현시킨 퇴행연골세포 내 콜레스테롤의 농도가 증가함을 확인하였다. 세포 내 콜레스테롤의 농도 증가는 콜레스테롤의 세포 내 합성 또는 유입 증가를 통해 설명할 수 있는데, 콜레스테롤 합성 저해제를 처리한 세포에서 여전히 콜레스테롤의 농도가 증가하는 것을 볼 때 퇴행연골세포 내 콜레스테롤 농도 증가는 세포 내 합성 때문이 아님을 알 수 있었다. 혈중 콜레스테롤 수송체 LDL 및 oxLDL의 수용체인 LOX1의 발현이 퇴행연골세포 및 퇴행성관절염 환자의 연골조직에서 공통적으로 증가하였으며, LOX-1의 발현을 억제한 퇴행연골세포에서 콜레스테롤 농도 증가가 완화되는 것을 볼 때, 퇴행연골세포 내 콜레스테롤 농도 증가는 LOX-1를 통한 oxLDL 유입에 의한 것임을 확인하였다. (그림 2)
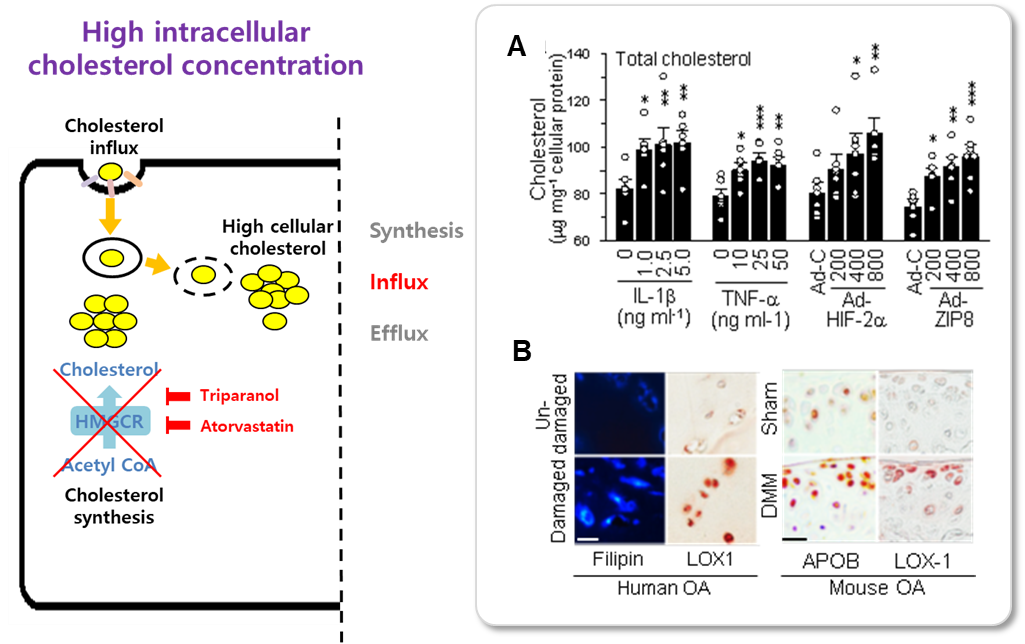
연골퇴행 조절인자인 IL-1, TNF-α, HIF-2α, ZIP8을 처리하거나 과발현시킨 연골세포에서 콜레스테롤 농도변화를 관찰하였다. 퇴행연골세포 및 퇴행성관절염 환자와 동물모델의 연골조직에서 콜레스테롤 수송체 LDL과 oxLDL의 수용체인 LOX-1의 발현을 확인하였다. 퇴행성관절염 상황에서 연골세포내 콜레스테롤 증가는 LOX-1 발현증가에 의한 콜레스테롤 유입에 증가에 기인한 것이다.
2. 퇴행연골세포 및 연골조직에서 옥시스테롤 변환효소인 CH25H와 CYP7B1의 발현증가 및 옥시스테롤의 축적 관찰
IL-1β 처리 및 HIF-2α, ZIP8 과발현 연골세포를 이용한 microarray 자료를 분석하여 세포 내 콜레스테롤 변환효소의 발현 변화를 분석한 결과, 콜레스테롤을 25-수화콜레스테롤 (25-HC)로 변화시키는 효소인 CH25H와 25-HC를 7α,25-수화콜레스테롤(7a,25-HC)로 변화시키는 CYP7B1의 발현이 공통적으로 증가함을 확인하였다. 실제 퇴행연골세포와 퇴행성관절염 환자 및 동물모델의 퇴행연골조직에서 CH25H 및 CYP7B1의 발현 증가를 mRNA, 단백질 수준에서 검증하였고, 퇴행연골세포에서 이들 효소에 의해 생성되는 25-HC 및 7α,25-HC가 축적됨을 확인하였다. (그림 3)
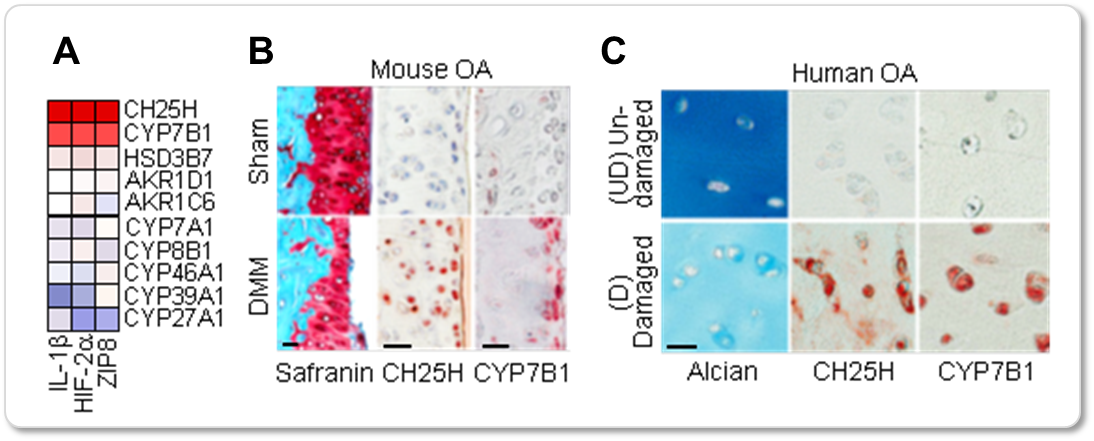
연골퇴행 조절인자인 IL-1β, TNF-α, HIF-2α, ZIP8을 처리하거나 과발현시킨 퇴행연골세포에서 콜레스테롤 변화효소 중 CH25H, CYP7B1의 발현변화를 microarray를 통해 관찰하였다(A). 퇴행성관절염 동물모델(B) 및 환자(C)의 퇴행연골조직에서 CH25H, CYP7B1의 발현증가를 확인하였다.
3. 옥시스테롤롤 생성효소 CH25H와 CYP7B1의 발현조절에 의한 연골퇴행 조절 관찰
CH25H 및 CYP7B1의 발현조절에 의해 퇴행성관절염이 조절되는지 확인하기 위해, CH25H 및 CYP7B1를 과발현시키는 아데노바이러스를 생쥐의 무릎에 주입하자 연골손상, 연골하골의 비후화, 골극의 생성과 같은 퇴행성관절염의 증상이 심화되었으며, CH25H의 발현억제 (knockout) 또는 shRNA를 이용한 CYP7B1의 발현저해가 일어난 생쥐에 퇴행성관절염을 실험적으로 유도한 경우 상대적으로 퇴행성관절염의 증상이 덜 나타남을 확인하였다. (그림 4)
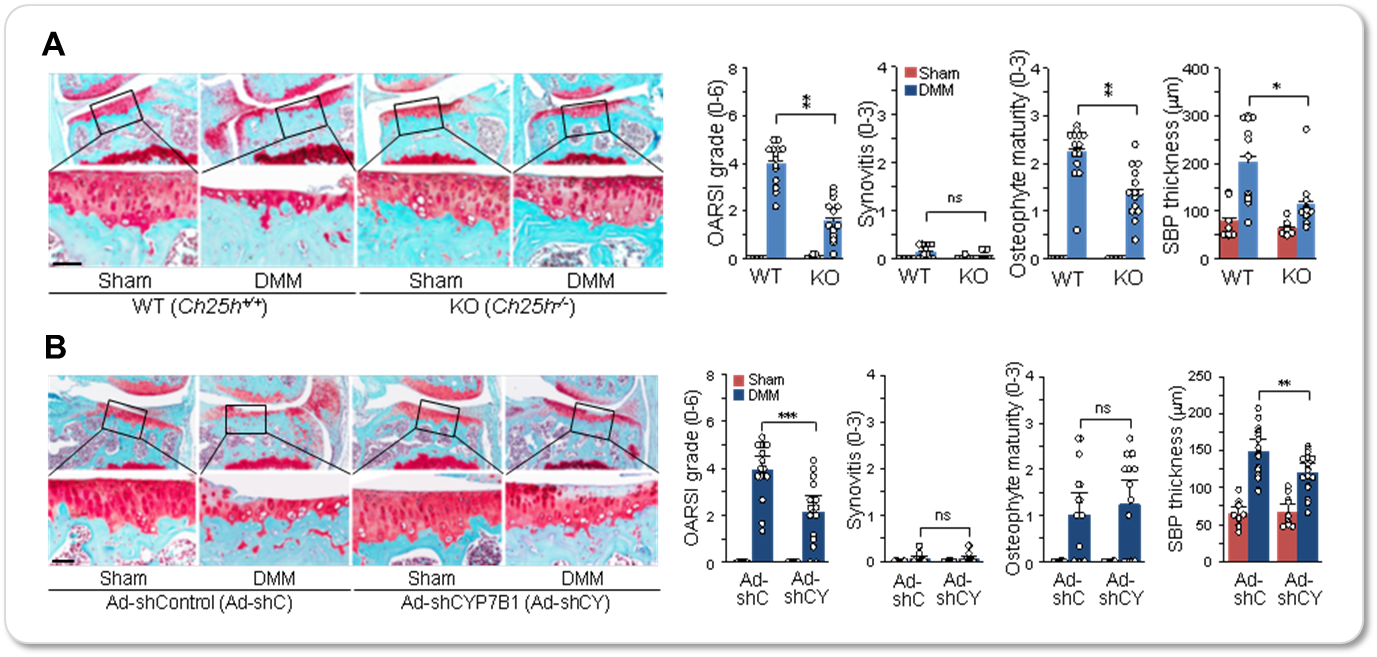 그림 4. CH25H, CYP7B1 발현조절에 의한 연골퇴행 조절 관찰
그림 4. CH25H, CYP7B1 발현조절에 의한 연골퇴행 조절 관찰
CH25H가 결손된 생쥐(A) 및 CYP7B1 shRNA를 과발현하는 아데노바이러스를 무릎에 주입한 생쥐(B)의 무릎 내측 반월상연골판 연결인대를 절개하여 퇴행성관절염을 유도한 뒤 8주 후 safranin O 염색한 무릎 관절조직을 관찰하여 연골손상 정도 (OARSI grade), 활막염증 정도, 골극형성 정도, 연골하골 비후화 정도를 정량화하였다. CH25H와 CYP7B1 유전자가 결손된 생쥐의 관절손상 정도가 현저히 감소함을 확인하였다.
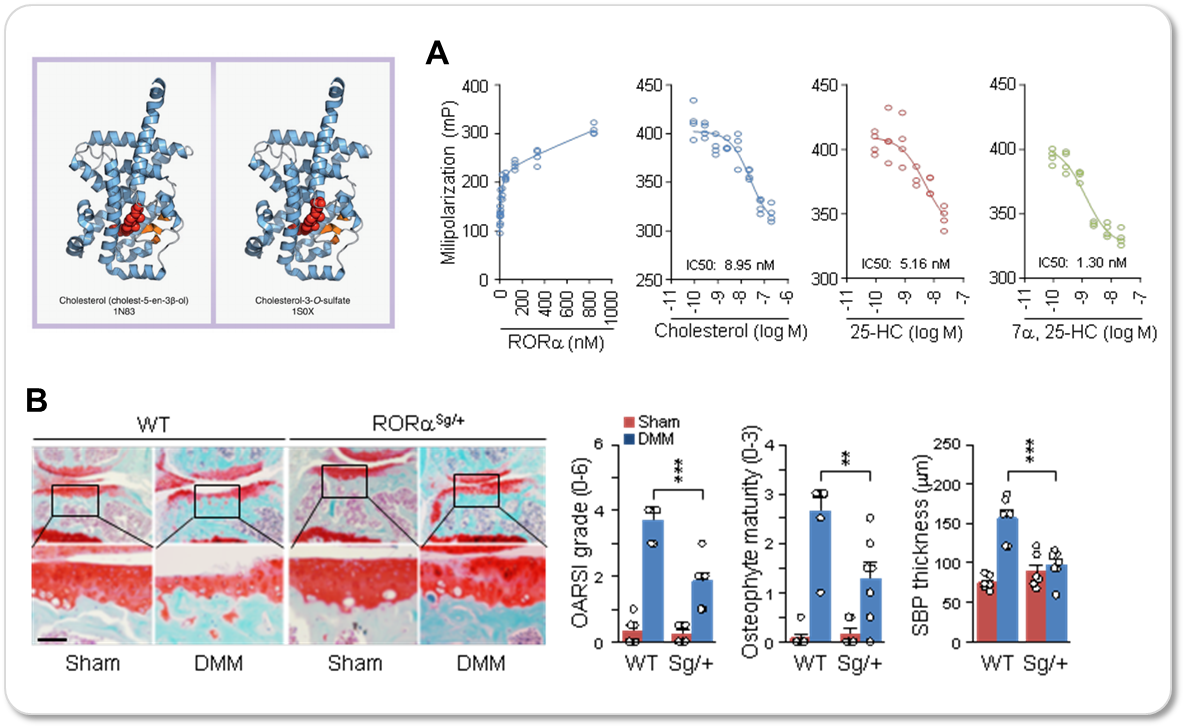
4. 퇴행연골세포 및 연골조직에서 핵고아수용체 RORα의 발현증가 관찰 및 RORα와 콜레스테롤, 옥시스테롤의 결합확인
연골세포 내 축적되는 콜레스테롤 및 옥시스테롤이 어떻게 연골퇴행을 조절하는지 규명하기 위해 퇴행연골세포 및 관절조직에서 콜레스테롤 및 옥시스테롤과 결합할 수 있는 핵고아수용체들의 발현을 확인한 결과, RORα의 발현이 공통적으로 증가함을 확인하였다. 반면 LXR, ESR1의 발현은 일관된 패턴이 나타나지 않았고, ROR family 중 RORγ의 경우 공통되게 발현이 감소함을 확인하였다. 이와 더불어 퇴행연골세포 내 축적되어있는 콜레스테롤, 옥시스테롤이 RORα의 리간드로 작용함을 형광편광측정을 통해 확인하였다. (그림 5)
5. 핵고아수용체 RORα의 활성 조절기전 규명 및 RORα의 발현조절에 의한 연골퇴행 조절 관찰
RORα의 활성 조절기전을 확인하기 위해 reporter gene assay를 진행한 결과, 옥시스테롤의 축적을 유도하는 CH25H, CYP7B1의 과발현이나, 콜레스테롤의 축적을 유도하는 IL-1β, TNF-α의 처리에 의해 RORα의 활성이 증가함이 확인되었고, 콜레스테롤 및 옥시스테롤의 직접적인 처리 역시 RORα의 활성을 조절함을 확인하였다. In vitro 실험 결과 RORα의 과발현에 의해 연골세포 내 연골기질 분해효소의 발현이 직접적으로 증가함을 확인하였다. 이런 결과들에 근거하여 in vivo 실험을 수행한 결과 RORα 과발현 아데노바이러스의 무릎 내 주입에 의해 퇴행성관절염의 증상이 심화되었고, RORα 돌연변이 생쥐에 실험적으로 퇴행성관절염을 유도한 경우 상대적으로 퇴행성관절염이 덜 일어남을 확인하였다. (그림 5)
연구의 성과 및 의의
본 연구는 현재까지 알려지지 않은 연골세포의 대사경로와 분자적 조절기전을 규명함으로써 퇴행성관절염의 근본원인을 밝혔다. 특히 콜레스테롤을 매개로 하는 세포신호전달 체계와 이에 따라 활성화되어 연골퇴행에 관여하는 유전자를 찾아냄으로써 퇴행성관절염의 새로운 표적을 제시하였고, 향후 보다 효과적이고 용이한 치료법 개발의 실마리를 제공한 것으로 여겨진다. 정상적인 연골세포에 비해 퇴행성관절염을 유발하는 퇴행연골세포는 oxLDL의 유입이 증가하여 세포 내 콜레스테롤의 농도가 증가하며, 콜레스테롤 대사효소인 CH25H, CYP7B1의 발현이 증가하여 옥시스테롤의 생성이 증가한다. 증가된 세포 내 콜레스테롤 및 옥시스테롤은 핵고아수용체인 RORα에 결합하여 전사활성을 증가시키며, RORα은 연골기질을 분해시키는 효소의 발현을 유도하여 퇴행성관절염을 조절한다 (그림 6). 이와 같은 연골퇴행의 분자적 조절 메커니즘의 규명은 연골퇴행을 근본적이고 직접적으로 제어할 새로운 약제의 개발과 치료기술의 실용화로 국민 보건복지 향상에 크게 기여를 할 것으로 사료된다. 또 본 연구를 통해 규명한 콜레스테롤 대사경로는 퇴행성관절염뿐만이 아니라 류마티스 관절염을 비롯하여 동맥경화와 같은 대사질환에서도 의미있는 역할을 할 가능성이 있어서 다양한 분야에서 파급효과가 기대된다.
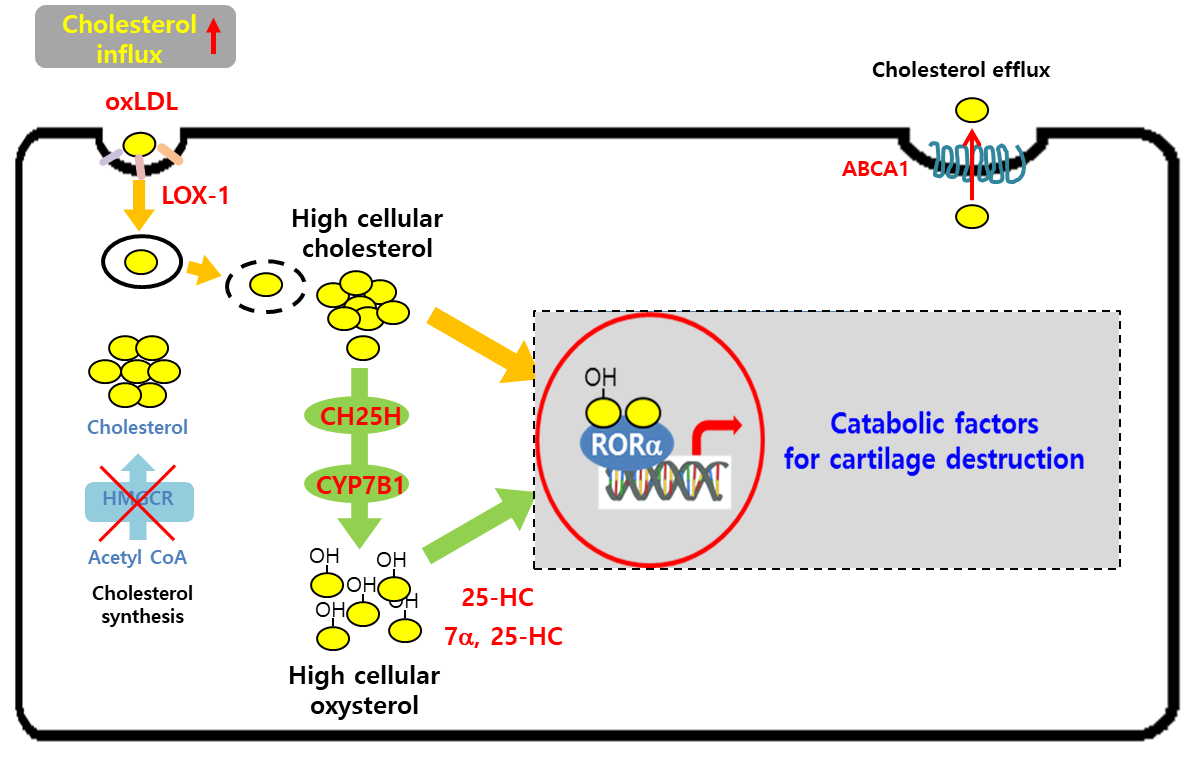 그림 6. LOX1-CH25H-CYP7B1-RORa에 의한 퇴행성관절염 조절기전
그림 6. LOX1-CH25H-CYP7B1-RORa에 의한 퇴행성관절염 조절기전
참고문헌
1.
|
질병 소분류(3단 상병) 통계|보건의료빅데이터개방시스템 [online] http://opendata.hira.or.kr/op/opc/olap3thDsInfo.do (Accessed March 21, 2020) |
2. |
Glyn-Jones, S., Palmer, A. J. R., Agricola, R., Price, A. J., Vincent, T. L., Weinans, H., and Carr, A. J. (2015) Osteoarthritis. The Lancet. 386, 376–387 |
3.
|
Yang, S., Kim, J., Ryu, J.-H., Oh, H., Chun, C.-H., Kim, B. J., Min, B. H., and Chun, J.-S. (2010) Hypoxia-inducible factor-2α is a catabolic regulator of osteoarthritic cartilage destruction. Nat Med. 16, 687–693 |
4.
|
Kim, J.-H., Jeon, J., Shin, M., Won, Y., Lee, M., Kwak, J.-S., Lee, G., Rhee, J., Ryu, J.-H., Chun, C.-H., and Chun, J.-S. (2014) Regulation of the Catabolic Cascade in Osteoarthritis by the Zinc-ZIP8-MTF1 Axis. Cell. 156, 730–743 |
5. |
Zhuo, Q., Yang, W., Chen, J., and Wang, Y. (2012) Metabolic syndrome meets osteoarthritis. Nat Rev Rheumatol. 8, 729–737 |
6.
|
Gierman, L. M., van der Ham, F., Koudijs, A., Wielinga, P. Y., Kleemann, R., Kooistra, T., Stoop, R., Kloppenburg, M., van Osch, G. J. V. M., Stojanovic-Susulic, V., Huizinga, T. W., and Zuurmond, A.-M. (2012) Metabolic stress–induced inflammation plays a major role in the development of osteoarthritis in mice. Arthritis & Rheumatism. 64, 1172–1181 |
7.
|
Gierman, L. M., Kühnast, S., Koudijs, A., Pieterman, E. J., Kloppenburg, M., Osch, G. J. V. M. van, Stojanovic-Susulic, V., Huizinga, T. W. J., Princen, H. M. G., and Zuurmond, A.-M. (2014) Osteoarthritis development is induced by increased dietary cholesterol and can be inhibited by atorvastatin in APOE*3Leiden.CETP mice—a translational model for atherosclerosis. Annals of the Rheumatic Diseases. 73, 921–927 |
8.
|
Ali, S. A., Al‐Jazrawe, M., Ma, H., Whetstone, H., Poon, R., Farr, S., Naples, M., Adeli, K., and Alman, B. A. (2016) Regulation of Cholesterol Homeostasis by Hedgehog Signaling in Osteoarthritic Cartilage. Arthritis Rheumatol. 68, 127–137 |
9.
|
Farnaghi, S., Prasadam, I., Cai, G., Friis, T., Du, Z., Crawford, R., Mao, X., and Xiao, Y. (2017) Protective effects of mitochondria-targeted antioxidants and statins on cholesterol-induced osteoarthritis. FASEB J. 31, 356–367 |
10.
|
Farnaghi, S., Crawford, R., Xiao, Y., and Prasadam, I. (2017) Cholesterol metabolism in pathogenesis of osteoarthritis disease. Int J Rheum Dis. 20, 131–140 |
첨부파일