
생화학분자생물학회입니다.
Cancer Therapeutics Research Laboratory (CTRL)
작성자
관리자작성일자
2019-04-01조회수
1127Cancer Therapeutics Research Laboratory (CTRL)
채영찬
울산과학기술원(UNIST) 생명과학부
[연구실 소개]
본 연구실은 울산과학기술원(UNIST) 생명과학부에 소속되어 있으며, 암 주변 미세환경(Tumor Microenvironment)으로부터 필연적으로 발생하는 여러 세포 대사 스트레스를 극복하기 위한 암세포의 스트레스 반응(Stress Response)중 하나인 암세포 에너지 대사 조절(cancer Metabolic Rewiring)이 암의 발생 및 성장, 전이, 항암내성등 악성화로 진행되는 과정에 미치는 영향과 그 기전에 대한 연구를 통해 암을 효과적으로 제어할 수 있는 방법을 개발하고 있다. 이를 위해 전통적인 분자세포생물학적 접근법과 단백질체 및 대사체 연구등 시스템적인 접근법을 종합적으로 사용하는 연구를 통해 궁극적으로 암의 진단 및 치료제 개발을 위해 활용 가능한 translational Research 연구를 수행하는 것을 목표로 하고 있다.
[연구 내용]
1. 항암제 개발을 위한 암세포 특이적 에너지 대사 신호 발굴
빠르게 성장하는 암세포가 정상세포와는 다른 세포대사 경로를 가지고 있으며 이를 통해 암의 빠른 증식을 위한 대사물질을 제공하며 이와 동시에 다양한 외부 스트레스 환경하에 빠르게 적응하여 생존을 할 수 있는 원동력을 제공한다고 알려져 있다. 암세포는 포도당을 분해하여 에너지(ATP)를 생성할 뿐만 아니라, 새로운 세포를 만드는 데 필요한 구성요소(예: 아미노산, 지질, 기타 화합물)도 만들기 위해 엄청난 양의 포도당을 흡수하며 현재 이와 같은 암세포의 대사적 특징을 활용하여 현재 임상에서 암 진단을 위해 사용하고 있는 양성자 단층촬영(PET, positron emission tomography) 영상은 이러한 암세포의 에너지 대사 이상에 기반하여 개발된 것이다. 이러한 암세포의 대사 재프로그래밍(metabolic reprogramming)은 외부 환경의 변화나 genetic mutation에 의해 조절이 되며 최근 이러한 암세포 에너지 대사의 이상은 암의 성장뿐만 아니라 암의 전이 항암내성, 면역회피 등 암의 악성화 전과정에 밀접하게 관여한다는 것이 밝혀지고 있다. 이에따라 암세포의 독특한 대사 경로를 타깃으로 약물의 개발이 활발히 이루어지고 있는 상황이다. 이에 따라 본 실험실은 대사체와 미토콘드리아 단백질체를 중심으로 암세포 특이적인 대사관련 미토콘드리아 단백질과 대사 신호를 발굴하여 이를 바탕으로 정상세포에는 영향을 주지 않고 암세포만 특이적으로 생장을 억제할 수 있는 대사 신호를 발굴하고자 한다.
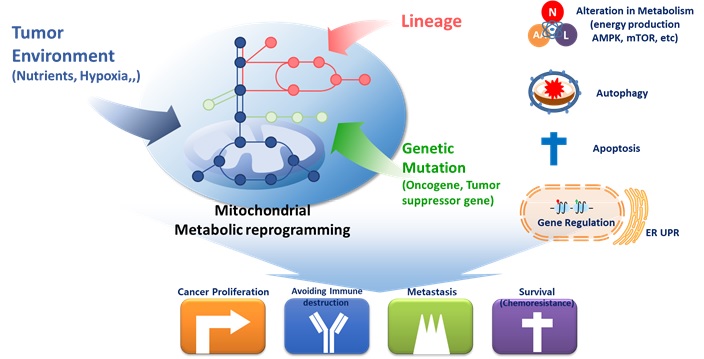
그림 1. 암세포 에너지 대사 신호의 이상과 그 기능
2. 암의 성장 및 전이 항암내성 과정에서 종양미세환경 스트레스와 암세포 대사 재프로그래밍 (Metabolic Reprogramming under Stress Condition in Cancer Cell)의 역할에 대한 연구
암은 발생 이후 계속해서 수많은 세포 스트레스에 노출이 되어진다. 빠르게 성장하는 암세포는 Mass를 형성하며 영양 결핍(Nutrient deprivation)이나 산증(Acidosis) 저산소증(Hypoxia)을 필연적으로 겪게 되며 invasion, 혈관내 순환, extravasation, target orgran에서의 생존(Dormancy)에 이르는 전이 전과정에서 지속적인 세포 스트레스를 겪게된다. 하지만 암세포는 이러한 종양 미세환경(Tumor Microenvironment) 스트레스를 성공적으로 극복하며, 이러한 극한 환경 속에서 생존, 성장한 암세포는 더욱 치료하기 힘든 악성 암이 된다. 암세포는 에너지 대사 재프로그래밍을 통해 종양미세환경하 스트레스하에서 급속한 세포 성장을 유지할 수 있을 뿐만 아니라, 세포 사멸억제(Survival), 침윤(Invasion), 전이(Metastasis) 더 나아가 항암제 내성(Chemotherapy Resistance)도 가지게 된다는 것이 밝혀지고 있다. 이에 본 연구진은 기존의 암 신호전달체계에 의한 암 대사조절에 대한 연구가 증식 과정의 암세포의 대사조절에 초점에 맞춰진 것과는 달리 암으로 인한 사망 원인의 대부분을 차지하는 암의 전이와 항암제 내성을 갖는 과정에서 다양한 대사 스트레스를 극복하고 생존해야 하기 위해 필요한 암세포의 에너지 대사 신호를 발굴하고자 한다. 이를 통해 암의 재발과 전이 등 암의 악성화를 억제할 수 있는 새로운 대사 치료 표적을 발굴하여 기존 항암치료를 대체 혹은 보완할 수 있는 암치료제 개발을 위한 연구를 진행하고 있다.
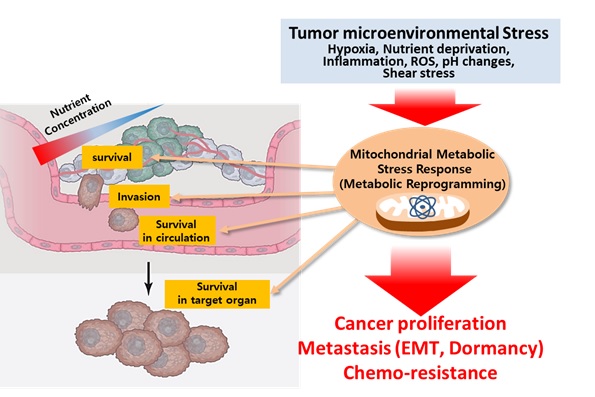
그림 2. 암의 악성화 과정에서 종양미세환경하 일어나는 다양한 스트레스에 대한 암세포 대사 반응의 역할
3. 미토콘드리아 항상성 조절을 통한 암세포의 Necrotic cell death의 유도
세포 에너지 대사를 담당하는 핵심 중추이며 동시에 세포사멸을 조절할 수 있는 핵심 세포소기관인 미토콘드리아는 내 외부의 환경 변화 및 자극에 반응하여 융합(fusion)과 분열(fission)을 통해 형태를 변화시키며 (mitochondrial dynamics), 이를 통해 mitophagy, 에너지 대사 조절 등 세포의 항상성을 유지한다고 알려져 있다. 미토콘드리아의 기능 이상이 암세포 발생에 중요하다고 알려져 있지만, 미토콘드리아 다이나믹스가 종양형성 및 발전에 어떠한 역할을 하는지에 대해서는 거의 알려져 있지 않다. 본 연구실은 유방암, 폐암, 전립선암 등 다양한 암종으로부터 미토콘드리아 다이나믹스가 비정상적으로 작동함을 발견하였으며 이를 통해 특정 미토콘드리아 다이나믹스 관련 단백질의 활성 조절하였을 때 미토콘드리아 막 전위를 조절할 수 있음을 밝혀내었으며 이를 통해 암세포의 마이토콘드리아 permeability 조절하여 necrotic cell death를 유도하는 매커니즘을 발굴하였다. 이를 활용하여 암 발생 및 진행에 관한 미토콘드리아 다이나믹스의 역할에 대한 분자적 기전을 해석하고자 연구를 수행하고 있다.
앞에서 언급된 주제 외에도 본 연구실은 암의 재발과 전이, 항암제내성에 핵심적인 역할을 하고 있는 암줄기세포에서 미토콘드리아와 세포 에너지 대사 이상과의 관련성과 그 역할에 대한 매커니즘에 대한 연구를 수행하고 있다. 그리고 종양미세환경하에 암세포-암주변세포(Stroma)로 간 exosome을 통한 암세포의 세포에너지 대사 조절과 그 역할에 대한 연구를 수행하고자 한다. 이와 같은 연구를 통해 궁극적으로 암세포의 성장 및 전이를 제어할 새로운 매커니즘을 갖는 차세대 대사 표적 항암제를 개발하는 것이 저희 연구실의 목표입니다.
연구책임자

채영찬, Young Chan Chae
주소: 울산과학기술원 공학 110동 409호
전화: +82-052-217-2524
Email: ychae@unist.ac.kr
Homepage: http://chaelab.unist.ac.kr/
[연구진구성]
박사후연구원: 이유건
석박사통합과정: 남예지, 임누리, 김희원
학부생: 박도홍

[대표 논문]
1. Chae, YC., Vaira, V., Caino, MC., Tang, HY., Seo, JH., Kossenkov, AV., Ottobrini, L., Martelli, C., Lucignani, G., Bertolini, I., Locatelli, M., Bryant, KG., Ghosh, JC., Lisanti, S., Ku, B., Bosari, S., Languino, LR., Speicher, DW. and Altieri, DC. “Mitochondrial Akt Regulation of Hypoxic Metabolic Reprogramming” Cancer Cell 2016. Aug 8;30(2):257-272
2. Seo, JH., Rivadeneira, DB., Caino, MC., Chae, YC., Speicher, DW., Tang, HY., Vaira, V., Bosari, S., Palleschi, A., Rampini, P., Kossenkov, AV., Languino, LR. and Altieri, DC. The mitochondrial unfoldase-peptidase complex clpxp controls bioenergetics stress and metastasis.PLOS Biology 2016. Jul 7;14(7):e1002507.
3. Caino, MC., Ghosh, JC., Chae, YC., Vaira, V., Faversani, A., Rampini, P., Kossenkov, AV., Aird, KM., Zhang, R., Webster, MR., Weeraratna, A., Bosari, S., Languino, L., Altieri, DC. “PI3K Therapy Reprograms Mitochondrial Trafficking to Fuel Tumor Cell Invasion” Proc Natl Acad Sci U S A 2015. Jul 14;112(28):8638-43
4. Ghosh, JC., Siegelin, MD., Vaira, V., Faversani, A., Tavecchio, M., Chae, YC., Lisanti, S., Rampini, P., Giroda, M., Caino, MC., Seo, JH., Kossenkov, AV., Michalek, RD., Schultz, DC., Bosari, S., Languino, L., Altieri, DC. Adaptive Mitochondrial Reprogramming and Resistance to PI3K Therapy.Journal of the National Cancer. Institute 2015. Feb 3;107(3)
5. Chae, YC., Angelin, A., Lisanti, S., Kossenkov, AA., Speicher, KD., Wang, H., Powers, JF., Tischler, AS., Pacak, K., Fliedner, S., Michalek, RD., Karoly, ED., Wallace, DC., Languino, LR., Speicher, DW. and Altieri, DC. “Landscape of the Mitochondrial HSP90 Metabolome in Tumors” Nature Communications 2013. July 10;4, Article number: 2139
6. Caino, MC., Chae, YC., Vaira, V., Ferrero, S., Nosotti, M., Martin, NM., Weeraratna, A., O’Connell, M., Jernigan, D., Fatatis, A., Languino, LR., Bosari, S. and Altieri, DC. Metabolic Stress Control of Cytoskeletal Dynamics and Metastasis.Journal of Clinical Investigation 2013. 123(7):2907–2920
7. Chae, YC., Caino, MC., Lisanti, S., Ghosh, JC., Dohi, T., Danial, NN., Villanueva, J., Ferrero, S., Vaira, V.,
Santambrogio, L., Bosari, S., Languino, LR., Herlyn, M., Altieri, DC. “Control of Tumor Bioenergetics and Survival
Stress Signaling by Mitochondrial HSP90s” Cancer Cell 2012. 22(3):331-44
첨부파일