
생화학분자생물학회입니다.
형광 프로브 기반 숙주세포 AI 감염 프로파일링을 통한 AI 아형 구별 연구
작성자
관리자작성일자
2019-01-01조회수
824Discrimination of Avian Influenza Virus Subtypes using Host-Cell Infection Fingerprinting by a Sulfinate-based Fluorescence Superoxide Probe
|
|
|
|
이준석 한국과학기술연구원 분자인식연구센터 한국과학기술연합대학원 KIST-School 바이오메디컬융합 전공 |
홍경태 한국과학기술연합대학원 KIST-School 바이오메디컬융합 전공 |
연구배경
Avian Influenza(AI) 바이러스 감염은 조류들을 심각한 병과 죽음으로 이르게 하는 전염병을 야기함으로써 그 피해가 심각하다고 할 수 있다 (1). 특히, 2013년에는 3천만 마리 이상의 동물들을 살처분해야 했을 뿐 아니라 1500명 이상의 인간들 또한 전염이 되었다고 보고되었다. 현재 많이 사용하고 있는 종란접종법은 샘플 속의 바이러스가 매우 적기 때문에 이를 수일 동안 종란에서 증식을 시킨 후, 증식된 샘플을 Hemagglutination Assay를 통해 분석을 해야 한다 (2). 이 방법은 AI 바이러스 존재 유무와 아형을 동시에 확인할 수 있다는 장점이 있지만 서열 분석을 하기 위한 특수장비와 긴 시간 동안 증식이 필요하다는 단점이 있다. 다른 방법으로는 AI 바이러스 표면 단백질인 Hemagglutinin(HA)와 Neuraminidase(NA)에 대한 항체 분석법이 있지만 AI 바이러스가 일으키는 빠른 돌연변이가 항원성을 바꾸기 때문에 선택성을 낮다는 단점이 있다. 이런 단점을 극복하기 위해 빠르고 간단하게 AI 바이러스를 검출할 수 있는 방법이 요구되고 있다.
본 연구는 AI 바이러스 감염 과정의 숙주세포 변화에 대한 분자생물학적 메커니즘을 화학생물학 기법을 이용하여 연구하였다. AI 바이러스가 세포에 감염이 되는 결정요인은 바이러스뿐 아니라 숙주세포의 특성에도 크게 영향을 받는데, 다양한 유전자 배경을 가진 세포주 모델에서 AI 감염 과정 동안 일어나는 변화를 화학 프로브 기반 분석기술을 확립하여 보여주었다.
그림 1. 형광 화학 프로브(SoDA-1) 기반 AI 감염 프로파일링 모식도
연구결과
1. 다양한 세포주에 대한 AI 바이러스 감염 감수성 지문화
인플루엔자 바이러스는 종류에 따라서 숙주세포 선택성을 갖는데, 이를 결정하는 큰 요인 중의 하나는 숙주세포 표면의 Sialic Acid-Galactose Glycan 구조다 (3). 이 화학결합이 α(2,3)인 세포는 Avian Influenza에 감염이 되고, α(2,6)인 세포는 Human Influenza에 감염을 일으키는 것으로 알려져 있다. 그리고 각기 다른 기관으로부터 유래된 세포는 특별한 Glycan Profiles를 가지고 있다고 보고되었다. 세포 표면의 Glycan은 매우 복잡한 혼합체로 어떤 세포도 한 종류의 Glycan 구조를 갖지 않음에 착안하여, 연구팀은 각기 다른 세포주의 표면 Glycan 다양성으로부터 AI 아형을 구별할 수 있을 것이라 생각했다 (4). 먼저, 가설을 입증하기 위해 Cell Line을 모으고 AI 바이러스에 감염시켜 보기로 하였다. 숙주세포의 다양성을 극대화하기 위해 5개종(사람, 쥐, 닭, 햄스터, 개) 8기관(폐, 간, 결장, 신장, 난소, 뇌, 자궁, 배아)의 다른 23개의 세포를 준비했다. 특히 인간의 폐 세포는 Sialic Acid-Galactose α(2,3) 모티프를 함유하고 있어 폐 세포를 가장 많이 준비했다 (5). 처음에 연구팀은 세포면역화학염색법(Immunocytochemistry)을 통해 세포 의존적 AI 감염 프로파일을 했다. 3개의 AI 바이러스(H1N1, H5N9, H9N2)를 각각의 세포에 24시간 감염시켰는데, 이 시간 동안 AI 바이러스는 숙주세포에서 증폭되고 감염된 세포는 아형 의존 항체를 이용해 단일 세포 수준에서 관찰이 가능하였다. 23개의 세포를 3개의 바이러스, 10개의 다른 농도에 6set를 준비해 감염시킨 뒤 각각 9번 이미지를 촬영하여 37,260개의 이미지 데이터를 얻었다. 이 이미지로 MDCK가 가장 감염이 잘 되는 것을 알 수 있었으며, H9N2 바이러스는 세포에 대한 감염성이 다른 두 바이러스보다 떨어지는 것을 확인하였다. 놀랍게도 세포주마다 다른 아형에서 특별한 패턴을 보였다. 예를 들어 MDCK, CHO-K1, NCI-H1299, HeLa, A498, DF-1은 H1N1에 대한 민감도가 높았고, Huh7.5, NCI-H23, SNU-2292, ACHN은 H5N9에 대한 감수성이 높은 걸 확인하였다. 이 데이터를 통해 AI 바이러스 감염은 숙주세포에 따라 달라지며 감수성은 아형에 의존하는 것을 규명하였다.
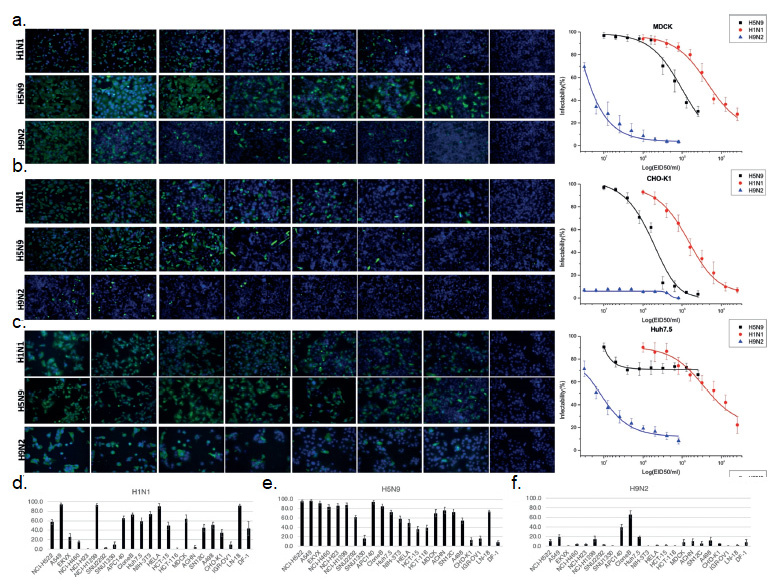
그림 2. 3개의 대표적 세포주들에 대한 AI 감염 형광 이미지와 AI 감염농도에 따른 감염율 그래프
(a) MDCK, (b) CHO-K1, (c) Huh7.5 (d,e,f) H1N1, H5N9, H9N에 대한 23개 세포주의 AI 감염 민감성 프로파일링 그래프.
2. 슈퍼옥사이드를 감지할 수 있는 형광 프로브 개발
AI 감염은 활성산소 생성, TRL-4 신호작용, 세포 매개 면역 활성 등의 숙주세포 반응들을 일으킨다(6). AI 바이러스의 비 구조 단백질(NS1)은 슈퍼옥사이드(Superoxide) 생성을 유도하며, 세포 내에서 슈퍼옥사이드와 AI 감염사이에 상관관계가 있음이 보고되었다(7, 8). 슈퍼옥사이드는 AI 감염에 의해 생성되는 ROS의 한 종이기 때문에 적절한 매개 변수가 될 수 있다고 생각하여 연구팀은 세포 침투성이 좋으며, 슈퍼옥사이드 라디칼 음이온을 검출할 수 있는 형광 센서를 디자인하였다.
현재 대부분의 슈퍼옥사이드 화학센서는 크게 두 가지로 나눌 수 있다. 첫 번째는 산화기반, 그리고 두 번째는 친핵성 반응 기반 형광센서다. 산화기반 센서는 다른 활성산소들과 반응을 하는 단점이 있다. 반면 친핵성 반응 기반 프로브는 최근에 개발되었으며, 다양한 형광단에 각기 다른 친전자성 작용기가 슈퍼옥사이드 선택성 반응을 보인다. 비록 슈퍼옥사이드에 대한 선택성이 좋지만 이전 센서들은 높은 cLogP값을 가지고 있어 생체 적합성이 좋지 않은 한계를 가지고 있었다. 그 이유는 대다수의 센서가 부피가 크고 Phosphinates나 Sulfoxides 같은 소수성 작용기를 가지고 있기 때문이다. 연구팀은 AI 감염 유도 슈퍼옥사이드 센서를 디자인하기 위해 두 가지 기준을 세웠다. 첫 번째 화합물의 cLogP 값이 의약 화학에서 약물 유사 평가를 위해 일반적으로 사용되는 기준인 5를 넘지 않으며, 두 번째는 세포면역화학염색법 결과를 보면 AI 감염이 세포질 전체에서 일어나기 때문에 세포질 전체에 퍼질 수 있도록 했다. 작은 사이즈, 좋은 용해도, 합성하기 용이함 그리고 전하 기반 소기관 특이성을 피하기 위해 중성 상태를 가진 T-Butyl Sulfonate가 작용기로서 유력한 후보가 되었다. 상업적으로 널리 쓰이는 Fluorescein과 T-Butyl Sulfinyl Chloride를 가지고 지방족 설핀화반응을 통해 높은 순도와 수율을 가진 형광 프로브를 만들었다. 항체 기반 AI 감염 측정에 비해 새로 개발된 센서는 농도를 컨트롤하기 쉬우며, 살아있는 세포 내 이미징이 가능하고, 비용이 적게 드는 장점을 가졌다.
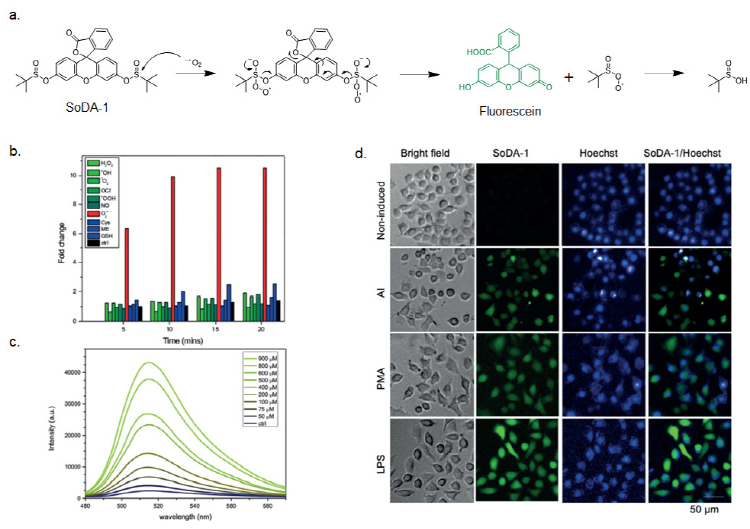
그림 3. (a) 친핵성 반응에 의한 슈퍼옥사이드 감지 메커니즘, (b) 프로브와 활성산소종들 간의 반응 후 형광 세기, (c) 농도에 따른 형광 세기 측정, (d) 프로브를 이용하여 세포 내 활성산소를 유도하는 물질인 PMA, LPS를 처리한 세포와 AI를 감염시킨 세포의 형광 패턴 비교.
3. 슈퍼옥사이드 센서를 활용한 AI 감염 여부 분석
형광 프로브를 합성한 뒤 연구팀은 첫 번째로 광물리적 특성과 슈퍼옥사이드 반응을 조사했다. 처음에 프로브는 형광이 죽어있다가 슈퍼옥사이드 생성물인 KO2를 일정량 이상 첨가한 뒤에는 형광이 극적으로 살아나는 것을 확인하였다. 슈퍼옥사이드 조건에서 형광이 살아나는 것을 확인한 뒤에 생체 적합성을 확인하기 위해 7개의 활성산소종과 3개의 bio-thiols를 준비한 뒤 형광을 측정하였다. 스크리닝으로부터 프로브가 5분 뒤부터 O2ㆍ–와 다선택적으로 반응하는 것을 알 수 있었다. 여기서 연구팀은 슈퍼옥사이드를 선택적으로 감지하는 설핀산염(Sulfinate) 기반 형광프로브를 SoDA-1(Superoxide Detecting Agent-1)이라고 명명했다.
다음으로 세포 내에서 슈퍼옥사이드를 생성을 유도한다고 알려진 PMA와 LPS를 준비하고 (9), 세포 내 SoDA-1의 분포와 슈퍼옥사이드 의존적 반응을 세포 이미징을 통해 확인해보았다. SoDA-1은 PMA, LPS, AI 감염 조건에서 형광을 나타냈고 세포질 전체에 염색되었다. 그리고 SoDA-1은 AI 감염 조건에서 다양한 형광강도를 띄었는데, 이것은 PMA나 LPS와는 다르게 AI 감염이 세포에 동일하게 되고 있지 않는다는 것을 의미한다. 이것을 확인하기 위하여 FACS 장비로 형광이 강한 쪽과 약한 쪽을 나눈 뒤 세포용해를 시키고 AI 바이러스 항체를 이용하여 웨스턴블랏 분석법으로 보았는데 형광이 강한 쪽에서 더 많은 AI 바이러스가 있음을 알 수 있었다.
연구 성과 및 의의
연구팀은 각종 세포가 바이러스에 감염되는 민감도가 다르다는 점과 감염 시 활성산소가 발생한다는 점에 착안하여 슈퍼옥사이드를 감지할 수 있는 형광 프로브 SoDA-1을 개발하였다. 슈퍼옥사이드 센서를 AI에 감염된 세포에 처리하여 나타나는 패턴을 분석하는 방식을 이용하였고, AI 바이러스 감염 여부와 아형을 구별할 수 있었다. 넓은 배양시설, PCR 장비, 3~4일 이상의 시간이 걸리는 기존의 종란접종법에 비해 세포 기반 분석법은 특수장비가 필요하지 않으며, 바이러스가 세포 배양 시 바이러스가 증폭될 수 있어 비용과 시간이 적게 들고 단일 세포 수준에서 감지가 가능하여 민감성이 뛰어나다는 장점을 갖고 있다.
이번 연구는 최초로 세포주에 대한 AI 바이러스 감염 프로파일링을 통해 감수성을 지문화하여 3종의 AI 바이러스 아형을 구별하는 것이 가능하다는 것을 증명한 점에 큰 의미가 있다. 세포주와 화학 프로브를 이용한 연구팀의 플랫폼을 적용하면 병원체 모니터링의 다양성을 야기함과 동시에 경제성 있는 진단기술을 보급하여 AI 피해를 최소화할 수 있을 것으로 기대한다.
참고문헌
1. Nelson MI and Holmes EC (2007) The evolution of epidemic influenza. Nat Rev Genet 8, 196-205.
첨부파일