
생화학분자생물학회입니다.
Autocrine 기반 Agonist 항체 선별 방법의 이해 및 응용
작성자
관리자작성일자
2019-01-01조회수
2190

1. 서론
2018년 노벨 화학상은 항체와 펩타이드의 파지 디스플레이(Phage Display) 기술을 최초로 개발한 조지 스미스(George P. Smith)와 그렉 윈터(Sir Gregory P. Winter)가 수상자로 선정되었다. 인간 항체를 기반으로 한 파지 디스플레이 기술을 활용하여, 미국 제약사 애브비(Abbvie)社는 2002년에 관절염·궤양성 대장염·강직 척추염 등에 효과를 가진 항 TNF-α(Tumor Necrosis Factor Alpha) 제제인 휴미라(Humira, Adalimumab)를 개발하였다. 이 항체를 기점으로 항체 치료제 개발에 속도가 붙기 시작했으며, 2018년 기준 세계 판매액 TOP 10에 해당하는 의약품 중 6개가 항체 치료제이다. 이는 세계 의약품 시장에서 약 13%의 비중에 해당되는 것으로, 향후 매출이 지속적으로 확대될 것으로 판단된다. 따라서 고효율을 가진 새로운 항체 신약 개발과 더불어 보다 효과적인 항체 개발 기술의 필요성이 날로 높아지고 있다.
인체는 세균 또는 바이러스 등과 같은 외부 병원균에 대항하여 면역반응을 일으킨다. 외부에서 침투한 병원 미생물들을 효과적으로 방어하기 위해 우리 몸의 B 림프구(B Lymphocytes)가 활성화되어 혈장 단백질의 일종인 항체(Immunoglobulin)를 생산한다. 활성화된 B 림프구는 항원 특이적인 증식으로 약 1012 가지 이상의 항체 분자를 분비할 수 있다. 체내에서 항체가 만들어지는 과정을 살펴보면, 먼저 B 세포가 직접 미생물 항원을 인식하거나, 항원 제시 세포(Antigen Presenting Cell; APC) 중 대식세포(Macrophage)가 병원 미생물을 포획한 뒤 항원을 제시하면 항원을 인식한 B 세포가 활성화된다. 활성화된 B 림프구는 항원 특이적으로 증식이 일어나는 Clonal expansion과 함께 활발하게 항체를 분비하는 Plasma cell로 분화한다. 하나의 항원에서 발현된 서로 다른 항원 결정기(Epitope)를 인지하는 항체의 집합을 다 클론 항체(Polyclonal Antibody)라 하며, 하나의 항원에 한 항원결정기만을 인지하는 항체를 단일 클론 항체(Monoclonal Antibody)라고 한다. 대표적인 Immunoglobulin G의 기본 구조는 두 개의 경쇄(Light Chain) 폴리 펩타이드와 두 개의 중쇄(Heavy Chain) 폴리 펩타이드가 이황화 결합으로 연결된 Y자 형태로 이루어져 있다. 중쇄와 경쇄는 N 말단 아미노산 서열의 다양성이 높은 가변 부위(Variable Region)와 나머지 고정된 아미노산 서열로 이루어진 불변 영역(Constant Region)으로 구분된다. 가변 부위 내에서도 특히 다양성이 높은 부분을 상보성 결정 영역(Complementarity Determining Regions. CDRs)이라 하며, 중쇄와 경쇄는 각각 세 개의 상보성 결정 영역으로 구성되어 있다. 항체 구조에서 항원과 결합하는 부분은 Fab(Antibody Binding Fragment)이며, 항체의 하위 부분인 Fc(Crystallizable Fragment)는 작동 기작(Effector Mechanism)을 활성화하는 역할을 한다. 항체는 수만 가지 서로 다른 항원 분자에 대항하기 위해 중쇄 클래스 전환(Heavy Chain Class Switching)을 통한 유전자 재배열과 한 항원에 대한 반복적인 노출에 따른 친화력 성숙(Affinity Maturation) 과정을 거쳐 타깃 항원만 특이적으로 결합하는 선택성을 가진다 (1). 따라서 질병의 원인 세포만을 표적으로 치료하는 것이 가능하며, 이를 이용해 부작용이나 독성이 거의 없는 치료제를 개발할 수 있다.
현재까지 개발된 단일 클론 항체들은 세포막 수용체의 작용을 억제하는 Antagonist들이 대부분이다. 하지만 단일 클론 항체는 타깃 수용체의 활성을 증가시킬 수 있는 Agonist로도 응용 가능하다. Agonist 항체는 세포막 또는 세포질에 존재하는 여러 가지 수용체와 결합하여 본래의 리간드처럼 유사한 기능을 유도할 수 있다. 예를 들어 GLP-1 (Glucagon Like Peptide-1)과 같은 대사 조절 호르몬이나 EPO(Erythropoietin), G-CSF(Granulocyte-colony Stimulating Factor)와 같은 면역 사이토카인, 내재 면역반응에 중요한 TLR(Toll-Like Receptor)와 공동 면역 자극 수용체(Co-Stimulatory Receptor)인 ICOS, OX40와 같은 타깃들은 활성을 억제하는 Antagonist가 아닌 이 타깃들의 활성을 유도할 수 있는 Agonist가 의약품으로서 높은 가치를 나타낼 수 있다.
이러한 Agonist 항체를 선택적으로 발굴하기에는 기존의 하이브리도마 기술 혹은 파지 디스플레이와 같은 친화도(Affinity) 기반 항체 선별법은 한계를 지니고 있어, 기존의 방식에서 벗어난 새로운 방법론적 접근이 필요하다. 따라서 본 리뷰에서는 본 연구진이 최근 새롭게 구축한 “활성 기반 항체 스크리닝(Autocrine-Based Antibody Screening)” 기술의 작용 원리를 설명하고 적용 사례 및 응용 가치를 제시하고자 한다.
2. 본론
2-1. 하이브리도마를 이용한 항체 치료제 개발
최초로 항체를 치료적인 목적으로 연구를 수행한 사람은 독일의 폰 베링(Emil Von Behring, 1854-1917)과 일본의 기타사토 시바사부로(Kistasato Shibasaburo, 1853-1931)이다. 이들은 파상풍균에 노출된 토끼 유래 혈청을 마우스에 주사한 후, 생쥐의 면역 반응을 활성화하여 항체 생산을 유도했다. 유도된 항체는 파상풍에 걸린 마우스를 치료하여 항체가 실제 치료제로 이용될 가능성이 있다는 것을 증명하였다 (2, 3). 하지만 특정 항원에 대한 선택적 작용이 낮았고, 고순도로 정제가 힘들었으며, 효능이 떨어져 실용성에 한계를 가졌다. 이러한 기술적 한계는 1975년 C. Milstein과 G. Kohler가 한 가지 항원 특이성을 가지는 항체 단백질만을 순수하게 대량 생산할 수 있는 하이브리도마 융합 기술(Hybridoma Fusion Technique) 개발을 통해 해결되었다. 하이브리도마 융합 기술은 수명이 10일 정도인 B 림프구에 반영구적으로 분열이 가능한 골수암 세포(Myeloma Cell)를 융합하여, B 림프구는 원하는 항원을 인식하는 항체를 분비하고, 동시에 골수암 세포는 지속적으로 Fusion 세포의 증식이 가능하도록 유도하는 기술이다 (4). 하이브리도마는 특정 항원에 특이적으로 결합할 수 있는 단일 항원 항체를 대량으로 제작 가능하며, 이 기술을 이용하여 개발된 첫 항체 치료제는 얀센(Janssen)의 이식 거부 반응 예방 면역 억제제(Orthoclone OKT3)로 1986년 FDA에서 승인받았다. 하지만 Mouse 기원 단일 클론 항체는 인체 투여 시 짧은 반감기, 인체에서 Mouse 항체를 비자기(Non-Self)로 인식함에 의한 새로운 2차 항체(Human Anti-Mouse Antibody; HAMA) 생성으로 약효가 감소하는 등 여러 가지 부작용이 나타났다. 따라서 1985년부터 생쥐 단일 클론 항체를 인간화 시킨 키메릭 항체(Chimeric Antibody)와 인간화 항체(Humanized Antibody) 제조기술이 개발되기 시작하였다. 1990년대부터는 Mouse 유래 부위를 점차 줄여서 완전한 인간 면역 글로불린 유전자를 생산하도록 유전자 조작된 형질 전환 마우스나 파지 디스플레이와 같은 기술이 개발되었다.
2-2. 인간 항체 라이브러리 기반 파지 디스플레이를 이용한 항체 치료제 개발
박테리오파지(Bacteriophage)는 세균을 숙주 세포로 하는 바이러스로 자신의 유전물질(DNA/RNA)을 숙주 세균에 주입하여 숙주 염색체에 삽입되거나 독립된 플라스미드 상태로 생존한다. George Smith 교수는 1985년 외래 DNA 단편을 파지 유전자의 외피 단백질(Minor Coat Protein) 유전자 pIII에 삽입하여 중간에 외래 서열을 갖는 융합 단백질을 생성하였다. 삽입된 서열은 새로운 파지가 만들어질 때 파지 코트 단백질의 한 부분으로 파지 표면에 발현되었다 (5). 이러한 “융합 파지(Fusion Phage)”를 이용한 기술을 파지 디스플레이(Phage Display)라고 한다. 융합 파지는 일반 파지보다 원하는 외래 서열에 대한 친화성이 1,000배 이상 높아 목적하는 단백질을 분리하는데 사용 가능하여 항체 제작에 활용되었다. 먼저 항체 제작을 위해 박테리오파지의 외피단백질에 외가닥의 ScFV 유전자를 삽입한 후 파지를 대장균에 감염시킨다. 1개의 대장균은 하나의 플라스미드를 수용하기 때문에 각각의 대장균 클론에서 발현하는 파지에는 서로 다른 항체 단편 융합 단백질이 존재한다. 최대 1011 가지 이상의 항체를 포함한 라이브러리를 제작한 다음 특정 표적 항원 단백질과 높은 친화도로 결합하는 파지를 선별한다. 선별한 항체 파지 중 항원 결합 부위 유전자를 다시 무작위 돌연변이 시킨 후 친화도 성숙(Affinity Maturation) 과정을 거치면 표적 단백질과 더 높은 친화도의 항체가 만들어질 수 있다. 이 방법은 현재 항체 개발을 위해 많은 제약회사가 사용하고 있지만 일부 포유류 항체는 박테리오파지가 발현하지 못하고, 복잡한 타깃에 대한 항체를 선별하기 어려운 문제가 있다. 또한 Affinity-Based Selection 방식은 단순히 결합 친화도가 높은 항체가 선별되기 때문에 Antagonist와 같이 활성을 차단하는 항체 개발엔 용이하나, 신호전달을 활성화시킬 수 있는 Agonist 항체 개발에는 한계를 가진다. 따라서 Agonist 항체 개발을 위해서는 해당 세포의 활성 조절을 기반으로 한 새로운 개념의 항체 선별 기술이 필요하다.
2-3. Agonist 항체 개발의 중요성
항체는 목표 물질을 “Activation(활성화)”하여 신호전달을 유도하거나 “Inhibition(억제)”하여 신호전달을 막을 수 있다. 이는 각각 Agonist와 Antagonist의 기능이 가능하다는 뜻이다. Agonist는 세포 내 수용체와 결합하여 신호전달의 주된 단계를 활성화시켜 생물학적 반응을 유도하는 물질이다. 생체 물질 리간드와 유사하며 선택적으로 수용체에 결합하여 수용 부위의 활성을 높이는 역할을 한다. Antagonist는 반대로 수용체에 특이적으로 결합한 후 기존의 리간드와 수용체의 상호작용을 방해하여 리간드에 의한 세포의 조절 작용을 억제시킬 수 있다. 예를 들어, 2018 노벨 생리 의학상의 주인공인 면역 항암치료법(Cancer Immune Therapy)에서 T 세포의 면역활성을 억제하는 단백질인 PD-1, CTLA-4 등을 차단하는 항체들은 모두 Antagonist 항체들로 Immune Checkpoint Co-Inhibitory 단백질들에 의한 종양의 면역 저항을 봉쇄할 수 있다. 반대로 면역 반응을 상승(Boost)시켜 암과 싸울 수 있는 T Cell Co-Stimulator인 ICOS, OX40, CD28, CD40, 4-1BB들 또한 항암 면역을 유도하는 데 있어 매우 중요하다 (6). Co-Stimulatory Receptor들을 활성화시킬 수 있는 Agonist 항체는 항암 면역 세포 기능에 필수적이며, 면역 항암 치료에 큰 기여를 할 수 있다. 이러한 면역 항암 치료제뿐만 아니라 Agonist 항체 치료제는 염증 관련 질환, 대사 질환 등 모든 질병 분야에 적용이 가능하며 응용 가능성은 매우 높다고 볼 수 있다.
2-4. Autocrine 기반 Agonist Antibody 선별
활성 기반 항체 개발을 위해서 크게 두 가지 시스템 구축이 필요하다. 첫 번째, “항체 라이브러리”의 사전 구축을 필요로 한다. 사전 구축된 항체 라이브러리를 이용하여 타깃 세포를 표적하는 항체를 선별할 수 있다. 여기서 본 연구진은 Autocrine 기반 항체 라이브러리 제작을 위해 지속적인 신호전달의 활성화를 유도할 수 있는 새로운 형태의 기술을 구축하였다. 이 기술은 인간 ScFv 라이브러리와 그 표적 수용체가 세포 표면에 동시에 발현하는 “Near Neighbor” 방식인데 이는 “ScFv-링커-PDGF 수용체의 막 관통 도메인”으로 구성되어 있다. ScFv 부위의 경우 Flexible한 링커를 통해 PDGF 수용체의 막관통 도메인과 연결되어 있어 ScFv가 발현되었을 때 세포 외부로 분비되지 않고 세포막에 부착된 형태로 발현하게 된다 (그림 1).
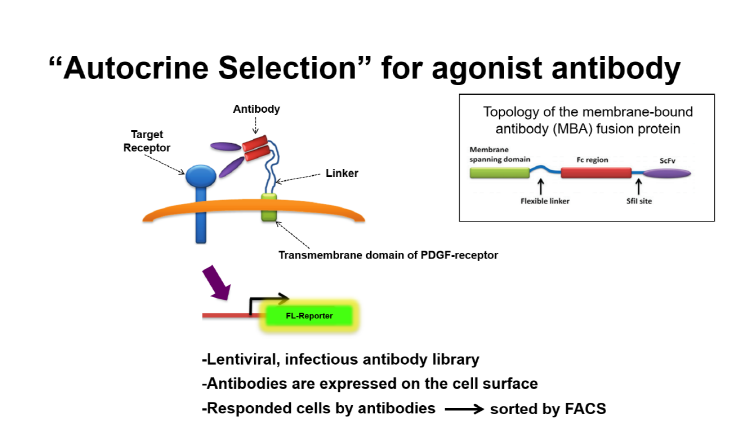
그림 1. Autocrine Selection
두 번째, 항체 라이브러리를 통해 선별된 항체가 타깃 세포의 활성화를 유도할 수 있음을 검증할 수 있는 “리포터 셀 시스템”구축이 필요하다. 리포터 셀이란, Agonist 항체가 타깃 세포의 수용체에 결합되었을 때 세포 내 신호 전달 과정을 통해 형광 유전자가 발현되는 세포를 말한다. 본 연구진에 의해 제작된 리포터 셀에 Agonist 항체가 Autocrine으로 자가 세포에 신호전달을 유도될 때 형광 유전자가 발현된다. 형광 유전자가 발현된 세포는 유세포 분류기를 통해 빠르고 정확하게 선별할 수 있다. 선별된 리포터 세포는 Deep Sequencing을 통해 Agonist 항체의 유전자의 발현 빈도 및 유전자 서열이 분석되고 최종적으로 활성 Agonist 항체가 선별된다. 이러한 Autocrine 기반 Agonist 항체의 선별 방법은 기존의 다른 방법보다 빠르고 매우 정확하다 (그림 2).
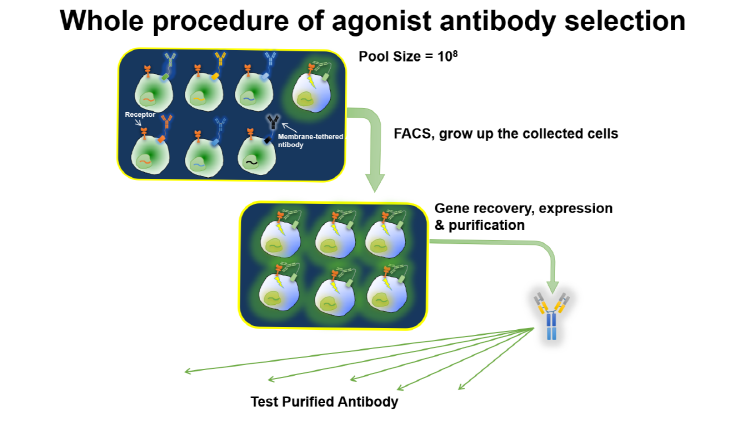
그림 2. Whole Procedure of Agonist Antibody Selection
2-5. Autocrine 기반 Agonist Antibody 선별법의 적용 사례
최근 Yea K. et al. (2015) 은 Autocrine 기반 Agonist Antibody 선별법을 이용해 CD34+ Bone Marrow Derived Cells에서 예상되지 않았던 Agonist 항체들의 새로운 기능에 대하여 보고하였다. 첫 번째, 콜라겐 수용체인 Discoidin Domain Receptor 1의 Angonist 항체는 CD34+ Bone Marrow Derived Cells를 자극하여 파골 세포로 분화를 유도하였다 (7, 8, 9). 다음으로, Axon Repulsion을 유도하는 netrin 수용체의 Agonist 항체는 CD34+ Bone Marrow Derived Cells를 자극하여, Glutamate Decarboxylase 1(GAD1)과 Tyrosine Hydroxylase(TH)와 같은 마커를 발현하는 신경 세포로의 분화를 유도하였으며 (10, 11, 12), Granulocyte-Colony Stimulating Factor(G-CSF) Agonist 항체는 CD34+ Bone Marrow Derived Cells을 자극하여 신경 세포로의 분화를 유도한다는 것을 밝혔다 (13, 14, 15). 그뿐만 아니라 Trombopoietin (16), Erythropoietin (16), Brain-Derived Neurotrophic Factor의 세포 조절 기능을 Mimic할 수 있는 Agonist 항체를 선별하였고 현재 후속 연구들이 활발히 진행되고 있다.
3. 결론
기존의 항체 선별법은 단순한 항체-항원 결합 능력에 기반한, 방법론적 한계에 봉착하여 Agonist Antibody의 개발을 위해서는 현재 새로운 방법론 개발이 절실한 상황이다. Patrick A. Mayes et al. (2018) 따르면 면역 보조 자극 수용체(Immune Co-Stimulatory Receptor)를 표적으로 하는 Agonist 항체의 경우 10년 넘게 임상 시험을 거쳤음에도 불구하고 현재까지 FDA에 승인된 약품은 전무한 것으로 알려져 있다 (17). 이는 Agonist 항체의 개발에 있어 항체의 선별 및 기능성 평가, 치료제로서의 가능성 검토 등 방법적인 어려움을 의미한다. 이렇듯 Agonist 항체의 개발은 의학적 응용 가치의 중대함에도 불구하고 기존의 방법론적인 한계로 인하여 Antagonist 개발 연구에 비해 비교할 수 없을 정도로 미진한 상황이다. 본 리뷰에서는 연구진이 새롭게 구축한 “활성 기반 Agonist Antibody 스크리닝” 기술을 이용하여 새로운 Agonist 항체 치료제를 선별할 수 있는 대안적인 툴로서의 가능성을 제시하고자 한다.
4. 참고문헌
1. Pauling, L. (1940) A theory of the structure and process of formation of antibodies. Journal of the American Chemical Society 2643-2657.
2. Alkan, S. S. (2004) Monoclonal antibodies: the story of a discovery that revolutionized science and medicine. Nature Reviews Immunology, 4(2), 153-156.
3. Von Behring E, Kitasato S. (1991) The mechanism of diphtheria immunity and tetanus immunity in animals 1890. Mol Immunol. 12:1317, 1319-20.
4. Köhler G, Milstein C. (1975) Continuous cultures of fused cells secreting antibody of predefined specificity. Nature 7;256(5517):495-7.
5. Smith GP. (1985) Filamentous fusion phage: novel expression vectors that display cloned antigens on the virion surface. Science 4705, 1315-7.
6. Qianxia Zhnag, Vignali DA. (2016) Co-stimulatory and Co-inhibitory Pathways in Autoimmunity. Immunity 44, 1034-1051.
7. Abbonante V, Gruppi C, Rubel D, Gross O, Moratti R, Balduini A. (2013) Discoidin domain receptor 1 protein is a novel modulator of megakaryocyte–collagen interactions. Journal of Biological Chemistry 288:16738-16746.
8. Hidalgo-Carcedo C, Hooper S, Chaudhry SI, Williamson P, Harrington K, Leitinger B, Sahai E. (2011) Collective cell migration requires suppression of actomyosin at cell–cell contacts mediated by ddr1 and the cell polarity regulators par3 and par6. Nature Cell Biology 13, 49–58.
9. Yea K, Xie J, Zhang H, Zhang W, Lerner RA. (2015) Selection of multiple agonist antibodies from intracellular combinatorial libraries reveals that cellular receptors are functionally pleiotropic. Current Opinion in Chemical Biology 26, 1-7.
10. Masuda T, Watanabe K, Sakuma C, Ikenaka K, Ono K, Yaginuma H. (2008) Netrin-1 acts as a repulsive guidance cue for sensory axonal projections toward the spinal cord. Journal of Neuroscience 28:10380-10385.
11. Serafini T, Colamarino SA, Leonardo ED, Wang H, Beddington R, Skarnes WC, Tessier-Lavigne M. (1996) Netrin-1 is required for commissural axon guidance in the developing vertebrate nervous system. Cell 87:1001-1014.
12. Masuda T, Watanabe K, Sakuma C, Ikenaka K, Ono K, Yaginuma H. (2008) Netrin-1 acts as a repulsive guidance cue for sensory axonal projections toward the spinal cord. Journal of Neuroscience 28:10380-10385.
13. Bar Shavit Z. (2007) The osteoclast : a multinucleated, hematopoieticorigin, bone-resorbing osteoimmune cell. Journal of Cellular Biochemistry 102:1130-1139.
14. Kogawa M, Hisatake K, Atkins GJ, Findlay DM, Enoki Y, Sato T, Gray PC, Kanesaki-Yatsuka Y, Anderson PH, Wada S, Kato N. (2013) The paired-box homeodomain transcription factor pax6 binds to the upstream region of the trap gene promoter and suppresses receptor activator of nf-kappab ligand (rankl)- induced osteoclast differentiation. Journal of biological Chemistry 288:31299-31312.
15. Xie J, Zhang H, Yea K, Lerner RA. (2013) Autocrine signaling based selection of combinatorial antibodies that transdifferentiate human stem cells. Proc Natl Acad Sci USA 110(20):8099-104.
16. Hongkai Zhang, Kyungmoo Yea, Jia Xie, Diana Ruiz. Ian A. Wilson, Richard A. Lerner. (2013) Selecting agonists from single cells infected with combinatorial antibody libraries. Chemistry & Biology 20, 734–741.
17. Patrick A. Mayes, Kenneth W. Hance, Axel Hoos. (2018) The promise and challenges of immune agonist antibody development in cancer. Nature Reviews Drug Discovery 17, 509–527.
첨부파일