
생화학분자생물학회입니다.
노화대사생리학 연구실 (Laboratory of Aging, Metabolism and Physiology)
작성자
관리자작성일자
2018-12-01조회수
764노화대사생리학 연구실 (Laboratory of Aging, Metabolism and Physiology)
이재민
DGIST 뉴바이올로지 전공
[연구실 소개]
본 연구실은 대구경북과학기술원(DGIST) 뉴바이올로지 전공에
소속되어 있고, 소포체 스트레스(Endoplasmic
Reticulum Stress, ER Stress)나 미토콘드리아 스트레스 같은 세포 스트레스가 노화 및 노화 질환(비만, 제2형 당뇨병, 암, 퇴행성 뇌질환)에
미치는 영향을 분자 수준의 기전 이해를 통해 연구하고 있습니다.
최근 급증하는 비만 인구의 증가는 현대사회에 있어 심각한 건강 문제가 되고 있습니다. 이는 비만이 단순히 체중의 증가만의 문제가 아니라, 최근 급증하는
제2형 당뇨병 및 이상지질혈증, 고혈압, 심혈관질환 등의 다양한 대사질환 나아가서 대장암이나 췌장암 등 특정 암의 발병의 원인을 제공하기 때문입니다. 미국의 경우 성인 인구의 1/3 이상이 체질량지수(Body Mass Index, BMI)가 30 이상인 비만이고, 2/3 이상은 비만을 포함한 BMI 25 이상인 과체중입니다. 비만의 급증은 단순히 미국만의 문제가 아니라 우리나라를 포함한 전 세계적인 문제가 되고 있습니다.
1. 비만과 대사질환
비만 및 비만에 의해 야기되는 제2형 당뇨병과 같은 대사질환의
경우 우리 몸의 대사 항상성 유지에 실패했을 때 일어납니다. 체중 조절은 렙틴(Leptin)을 비롯한 다양한 호르몬 및 신경 조절을 통해 이루어지는데, 대표적인
체중 조절 호르몬인 렙틴은 지방조직에서 합성되어 혈액 속으로 분비가 되고 궁극적으로 뇌의 시상하부에 존재하는
AgRP 및 POMC 신경세포의 활성조절을 통해 체중 감소를 유도합니다. 렙틴을 통한 체중 조절 항상성 기전이 존재함에도 현재 비만이 급증하는 이유는 과영양과 운동부족이 렙틴 저항성을
유도하기 때문이라는 것이 알려져 있습니다.
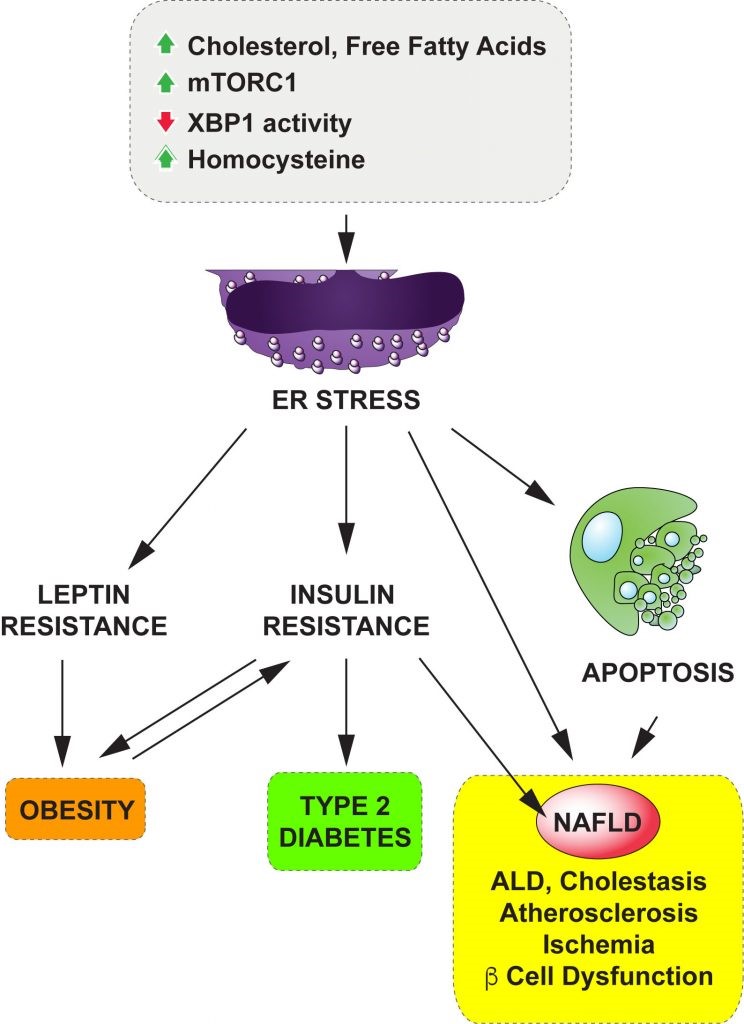
그림 1. 세포
스트레스(소포체 스트레스)와 대사질환
혈당 및 당 대사의 경우 음식 섭취 시 증가한 혈당을 췌장의 베타세포가 인식하고 이에 따라 인슐린 분비를
증가시키면 인슐린은 간, 근육, 지방조직에 있는 인슐린 수용체에
결합하여 간으로부터의 추가적인 당 생합성(Gluconeogenesis)을 억제하고 동시에 근육과 지방조직으로
혈당을 흡수하도록 촉진함으로써 혈당을 낮춥니다. 하지만 비만은 간, 근육, 지방조직에서 인슐린 저항성을 일으키고 궁극적으로는 제2형 당뇨병을
일으킵니다.
비만과 제2형 당뇨병의 원인이 되는 렙틴 저항성 및 인슐린
저항성의 원인이 무엇인지에 대한 연구는 전 세계적으로 활발히 진행이 되고 있음에도, 아직 치료에 이용할
만한 성과는 나오지 않고 있습니다. 최근 진행되고 있는 많은 연구들은 비만과 제2형 당뇨병과 같은 대사질환들이 대사적으로 중요한 뇌의 시상하부, 간, 근육, 지방조직의 세포 내 항상성 유지에 문제가 있을 때 나타나는
세포 스트레스에 의해 발병하고, 이들 세포 스트레스를 경감시키면 질환이 완화된다는 것을 보여주고 있습니다. 이는 세포 스트레스 관련 신호전달계들을 타깃하는 약물 개발이 효과적인 대사질환 치료에 이용될 수 있다는 것을
시사해 줍니다 (그림 1).
2. 소포체 스트레스(ER Stress)와 미접힘 단백질 반응(Unfolded
Protein Response, UPR)
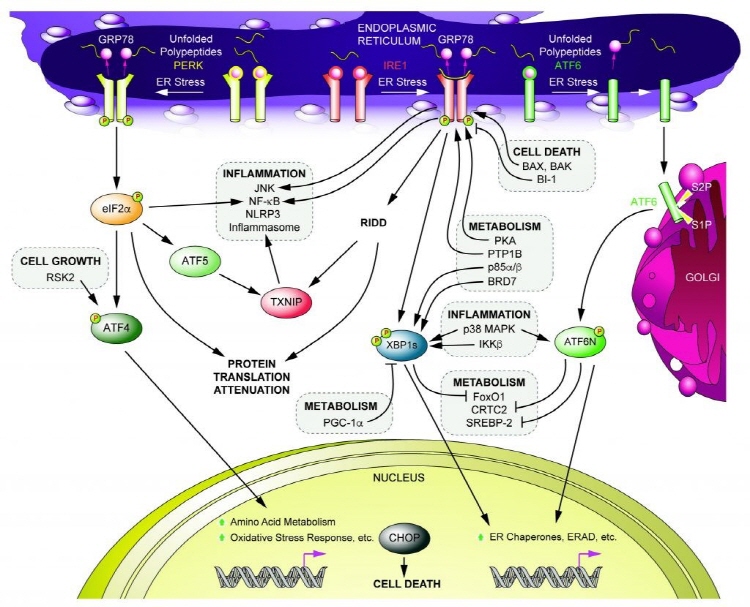
그림 2. 미접힘 단백질 반응(Unfolded Protein Response, UPR)과 UPR 상호작용체(Interactome)
세포 스트레스는 산화 스트레스(Oxidative Stress), 미토콘드리아
스트레스, Heat Shock Stress, 소포체 스트레스(ER
Stress) 등이 있는데, 이중 소포체 스트레스는 직접적으로는 분비단백질이나 막단백질들이
적절한 3차 구조 형성에 실패하고 소포체 내에 축적됨으로써 발생합니다.
또한, 비만이나 제2형 당뇨병의 원인이 되는
과영양 상태가 대사 중요 조직인 시상하부, 간, 지방조직에서
소포체 스트레스와 같은 세포 스트레스를 유도한다는 것이 밝혀져 있습니다.
세포 스트레스가 발생하면 세포는 세포 내 신호전달계를 이용해서 항상성을 유지하려고 하는데, 소포체 스트레스의 경우 이를 미접힘 단백질 반응(Unfolded
Protein Response, 줄여서 UPR)이라고 합니다. 동물 세포에서는 소포체에 존재하는 PERK(Protein Kinase
RNA-like ER Kinase), IRE1(Inositol-Requiring Protein-1), ATF6 (Activating
Transcription Factor-6)이라는 세 종류의 막단백질들에 의해 UPR이 시작됩니다 (그림 2). PERK은 소포체 스트레스 하에서 eIF2α(Eukaryotic Initiation Factor 2α)의 인산화를 통해 전반적인 단백질 번역(Protein Translation)을
억제하고, IRE1은 소포체 스트레스 하에서 XBP1 mRNA를
Splicing시킴으로써 활성을 가지는 Spliced
XBP1(sXBP1 또는 XBP1s) 전사인자를 만들어 냄으로써 세포 스트레스 조절에 관여합니다. ATF6는 소포체 스트레스 하에서 골지(the Golgi)로 이동하고
그곳에 있는 단백질 절단 효소인 S1P(Site-1 Protease)와 S2P에 의해 전사인자 기능을 하는 도메인이 분리됨으로써 UPR 기능을
수행하는데, ATF6와 XBP1s는 소포체 항상성 회복에
관여하는 유전자들의 발현을 증가시킴으로써 소포체 스트레스를 경감시키는 역할을 합니다 (그림 2).
3. UPR 및 신호전달계 상호작용체(Interactome)
본 연구실에서 관심을 가지고 연구하려는 내용은 세포 스트레스 신호전달계 상호작용체의 구성과 조절에 대한
연구입니다. UPR 신호전달계의 경우 다른 신호전달계들과의 상호작용,
즉 UPR Interactome 형성을 통해 대사조절에 관여한다는 것이 본인이 관여한 연구를
비롯한 다른 많은 연구들을 통해 알려졌습니다 (그림 2). 예를
들면 간에서 ATF6는 CRTC2(CREB-Regulated
Transcription Coactivator-2)와 Protein-Protein
Interaction을 하고 이를 통해 CRTC2의 활성을 억제함으로써 당 생합성을 낮추고. XBP1s도 간에서 당 생합성에 관여하는 전사 인자인
FoxO1(Forkhead Box Protein O1)을 Protein-Protein Interaction을
통한 단백질 분해를 촉진함으로써 FoxO1에 의해 유도되는 당 생합성을 억제합니다. XBP1s의 경우 전사 인자로 기능하는 도메인이 없어도 FoxO1 조절을
통한 당 항상성에 관여하는 것으로 봐서 XBP1s와 다른 신호전달계 인자와의 Protein-Protein Interaction이 당 대사 조절의 주된 기전으로 보입니다. 또한 이후의 연구들을 통해 p38 MAPK, PI3K
(Phosphoinositide 3-Kinase) p85 Regulatory Subunit, PGC-1a, IKK1b 등 항염증과
대사조절에 관여하는 신호전달계 인자들이 XBP1s의 활성을
Protein-Protein Interaction을 통해 조절하는 상위 조절 인자로 밝혀지기도 했습니다 (그림 2). 이는 소포체 스트레스 관련 UPR 신호전달계 인자들이 서로 다른 Interactome 형성을
통해 다양한 생리 조절에 관여함을 보여줍니다. 본 연구실은 이러한 다양한 신호전달계 간 상호작용이 어떻게
조절되는지 또한 어떻게 생리대사 조절에 관여하는지 다음의 구체적인 방향을 통해 연구하고자 합니다.
1. UPR 상호작용체 및 신호전달계 상호작용체를 구성하는 신규 인자 탐색 및 조절 기능 연구
2. 세포스트레스 신호전달 인자의 Post-Translational Modification 탐색 및 기능 연구
3. 세포스트레스 신호전달계 상호작용체의 생리대사 조절 기전 및 대사질환에의 영향 연구
[대표논문]
1. Lee, J., Salazar Hernandez, M.
A., Auen, T., Mucka, P., Lee, J. and Ozcan, U. (2018) PGC-1alpha functions as a
co-suppressor of XBP1s to regulate glucose metabolism. Mol Metab 7, 119-131.
2. Lee,
J., Liu, J., Feng, X., Salazar Hernandez, M. A., Mucka, P., Ibi, D., Choi, J.
W. and Ozcan, U. (2016) Withaferin A is a leptin sensitizer with strong
antidiabetic properties in mice. Nat Med
22, 1023-1032.
3. Liu,
J., Lee, J., Salazar Hernandez, M. A., Mazitschek, R. and Ozcan, U. (2015)
Treatment of obesity with celastrol. Cell
161, 999-1011.
4. Lee,
J. and Ozcan, U. (2014) Unfolded protein response signaling and metabolic
diseases. J Biol Chem 289, 1203-1211.
5. Lee,
J., Sun, C., Zhou, Y., Lee, J., Gokalp, D., Herrema, H., Park, S. W., Davis, R.
J. and Ozcan, U. (2011) p38 MAPK-mediated regulation of Xbp1s is crucial for
glucose homeostasis. Nat Med 17, 1251-1260.
6. Zhou,
Y., Lee, J., Reno, C. M., Sun, C., Park, S. W., Chung, J., Lee, J., Fisher, S.
J., White, M. F., Biddinger, S. B. and Ozcan, U. (2011) Regulation of glucose
homeostasis through a XBP-1-FoxO1 interaction. Nat Med 17, 356-365.
7. Park,
S. W., Zhou, Y., Lee, J., Lee, J. and Ozcan, U. (2010) Sarco(endo)plasmic
reticulum Ca2+-ATPase 2b is a major regulator of endoplasmic reticulum stress
and glucose homeostasis in obesity. Proc
Natl Acad Sci U S A 107,
19320-19325.
[연구책임자]
.jpg)
이재민 조교수
주소: 42988 대구광역시
달성군 현풍읍 테크노중앙대로 333 DGIST
전화: 053-785-1750
Email: jaeminlee@dgist.ac.kr
Homepage: https://physiology.dgist.ac.kr/
[연구진구성]
교수: 이재민
박사후 연구원: 김성우
박사과정: Yurong Gao, 노현철, 김수정
석사연구원: 유혜람
