
생화학분자생물학회입니다.
인간사이토메갈로바이러스(HCMV) US9 단백질의 인터페론 면역반응 회피 기전 연구
작성자
관리자작성일자
2018-12-01조회수
1199Human cytomegalovirus-encoded US9 targets MAVS and STING signaling to evade type I interferon immune responses
|
|
|
최현진 연세대학교 시스템생물학과
|
이성욱 국립암센터 면역치료연구과
|
박보연 연세대학교 시스템생물학과
|
연구배경
우리 몸의 세포는 패턴 인식 수용체(Pattern Recognition Receptor; PRR)가 있어서 바이러스로부터 유래한 핵산(Nucleic Acid)을 인지하여 제1형 인터페론(Interferon; IFN)의 생성을 포함한 면역 방어 기전이 활성화된다 (1). DDX41, ZBP1, IFI16과 같은 DNA 센서는 바이러스 DNA를 감지하는데 필요하며, 이러한 DNA 수용체는 ER에 있는 STING 단백질을 통해 신호를 전달한다 (2). 또한 바이러스 RNA 분자를 감지하는 RIG-I-수용체는 Mitochondria에 있는 MAVS 단백질과 상호 작용을 통해 신호를 전달한다. MAVS와 STING은 TBK1에 의한 IRF3의 인산화를 유도하여 제1형 IFN이 생성되도록 한다 (3, 4).
많은 바이러스는 숙주 면역계를 회피하기 위한 기전을 발전시켰으며, 일부 바이러스 단백질(HCV NS4B, HPV E7, Adenovirus E1A)은 MAVS/STING에 의한 면역 반응을 억제한다고 보고되었다 (5-7). 하지만 MAVS/STING 신호전달 경로의 주요 매개체를 표적으로 하는 HCMV의 면역 회피 기전에 대한 연구는 아직 이루어지지 않았다. HCMV는 감염 초기 단계에서 염증 유발성 사이토카인(Cytokine) 또는 케모카인(Chemokine)의 발현을 증가시킴으로써 바이러스 전파를 촉진하지만, 감염 후반기에 선천성 면역을 억제하여 숙주 내에서 바이러스 지속성을 유도한다 (8, 9). 이러한 결과와 일치하여 HCMV의 US9는 초기 단계에서는 거의 발현되지 않고 감염 후 6-8시간 이후부터 발현되며 48시간 최대로 발현하였다 (10). 그러므로 US9 단백질이 숙주 세포에서 장기적인 HCMV 지속성 또는 생존과 관련될 수 있으며, 이 연구에서 바이러스 면역 회피에 관여하는지를 확인하고자 하였다.
감염의 후기 단계에서 HCMV US9 단백질의 IFN-β 생성 및 항바이러스 반응에 대한 영향성을 확인하기 위하여 MAVS 및 STING을 매개로 한 신호전달 경로 억제제로서의 기능 및 작용 기전에 대한 연구를 진행하였다. US9는 MAVS를 Mitochondria에서 Cytosol로 누출시켜 IRF3 활성화를 억제하고, ER에서는 STING-TBK1 신호전달 경로를 방해하는 기전을 통해 IRF3의 핵으로의 이동 및 IFN-β 생성을 억제하였다. US9의 C-말단 부분이 MAVS- 및 STING- 매개의 IFN 생산을 억제하는데 중요한 도메인이라는 것을 확인하였으며, 직접적으로 HCMV 감염을 통해서 US9 단백질이 MAVS 및 STING에 의한 면역 반응 억제에 관여하는 것을 관찰함으로써, US9 단백질이 HCMV의 면역 회피에 중요한 바이러스 단백질임을 확인하였다.
연구결과
1. 인간사이토메갈로바이러스(HCMV) US9 단백질은 제1형 인터페론 면역 반응을 회피하기 위해 MAVS 및 STING 신호 전달을 표적으로 한다.
HCMV Genome은 UL 부분과 US 부분으로 구성되며 각 부분은 반복 서열(TRL/TRS 및 IRL/IRS)에 의해 구분된다. US9 단백질은 N-terminal Signal Sequence, Luminal 도메인, Transmembrane(TM) 도메인, 그리고 Cytoplasmic Tail(CT) 도메인을 가지고 있다 (그림 1a). US9의 기능을 이해하기 위해 세포 내 위치를 관찰한 결과, Nuclear Fraction에는 존재하지 않으나 Cytosolic/ER Fraction에 존재하며, 많은 양의 US9 단백질이 Mitochondria Fraction에서 확인되었다 (그림 1b). 추가적으로 형광현미경 분석법을 이용하여 US9 단백질이 ER과 Mitochondria에서 관찰되었다 (그림 1c). ER과 Mitochondria는 STING 및 MAVS에 의한 항바이러스 신호 전달을 위한 중요한 곳이므로, STING 및 MAVS 신호 전달 과정을 활성화시킬 수 있는 Salmon Sperm DNA 또는 Synthetic Double-Stranded RNA(poly(I:C)) 처리 이후에 IFN-β 생성에 대한 US9의 영향을 관찰하였을 때, IFN-β mRNA 발현의 감소를 확인하였다 (그림 1d). 또한 직접적으로 MAVS 및 STING의 Ectopic 발현을 통해서 IFN-β mRNA 발현을 활성화시킨 세포에서 US9 단백질에 의해 IFN-β 발현이 억제되는 것을 확인하였다 (그림 1e). 따라서 이러한 결과는 ER과 Mitochondria에서 US9 단백질이 STING 또는 MAVS 매개에 의한 IFN-β 생성을 억제한다는 것을 알 수 있다.
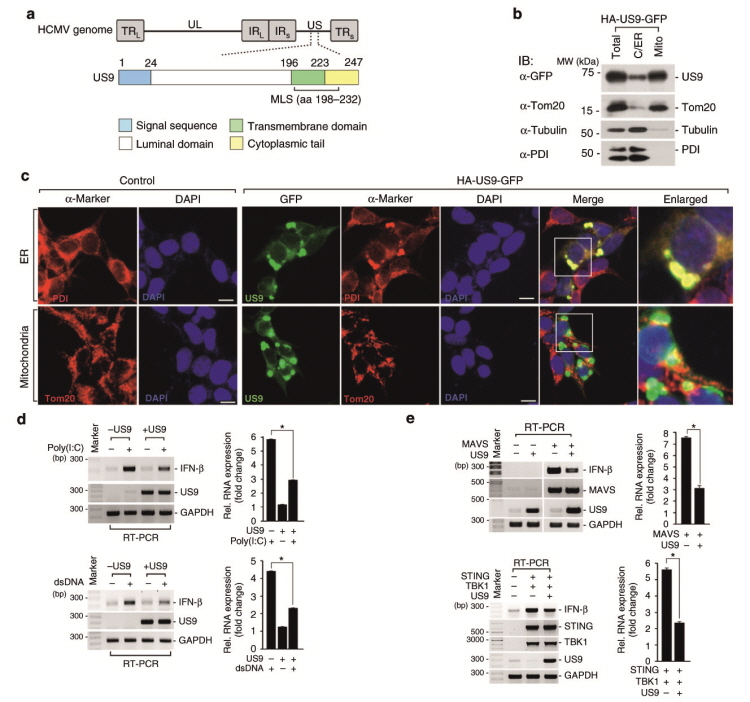
그림
1. ER 및 Mitochondria에 존재하는 US9 단백질에
의한 MAVS/STING 매개 IFN-β 생성 억제
2. HCMV US9 단백질은 MAVS의 감소와 MAVS의 Mitochondria로부터
누출을 유도한다.
MAVS 매개의 신호를 억제하는 US9 단백질의 분자 기전을 이해하기 위해 US9 단백질이 MAVS 발현 패턴에 미치는 영향에 대하여 관찰하였다. US9 단백질이
발현되지 않는 세포에서 MAVS는 고르게 분포되었지만, US9 단백질을
발현하는 세포에서 분산된 US9 단백질은 MAVS와 중첩되어
있었고, US9 단백질이 많이 발현되는 곳은 MAVS 발현이
결핍되어 있으며 (그림 2a), 이것은 MAVS 발현이 US9 단백질에 의해 감소한다는 것을 Immunoblotting 실험으로 확인되었다 (그림 2b). 추가적으로 Immunoprecipitation 방법에 의해
MAVS와 US9 단백질이 서로 결합하는 것을 알 수 있었다. 또한 Mitochondria의 Membrane
Potential(Δψm)의 손실은 MAVS 매개에
의한 항바이러스 반응의 결함과 관련이 있으며, ΔΨm에 민감한
염색인 MitoTracker Orange를 사용하여 US9 단백질이
직접적으로 영향을 주는 것을 확인할 수 있었다 (그림 2c). US9
단백질을 발현하는 세포에서 MAVS의 세포 내 분포를 조사하였을 때 US9 단백질에 의해 MAVS의 비정상적인 위치를 관찰하였고, 또한 MAVS가 Mitochondria에서
Cytosol로 누출된다는 것을 Cell Fractionation 실험을
통해서 확인할 수 있었다 (그림 2d). 이러한 결과는 US9 단백질이 MAVS 발현의 감소와 Mitochondria부터 MAVS 누출을 유도하여 MAVS 매개에 의한 IFN 생산을 억제한다는 것을 보여준다.
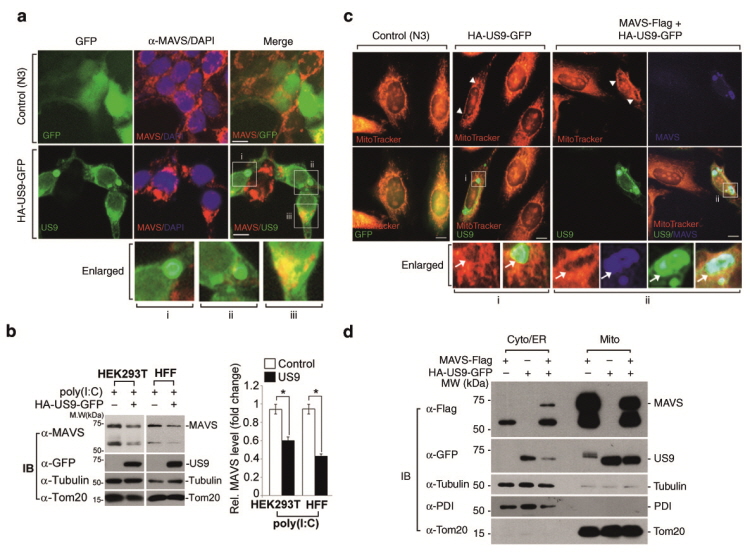
그림 2.
US9 단백질에 의한 MAVS 발현 감소와 MAVS의
Mitochondria로부터 누출
3. HCMV US9 단백질은 STING-TBK1 신호전달을 방해한다.
다음으로 HCMV US9 단백질이 ER에서
STING-TBK1 매개의 신호전달 경로에 영향을 주는지 확인하기 위한 실험을 진행하였다. 세포를 dsDNA로 활성화한 이후, US9 단백질과 STING 또는 TBK1의 세포 내 위치를 형광현미경 분석으로 관찰한
결과, US9 단백질이 STING 및 TBK1 단백질과 세포 내에서 Colocalization 되는 것을
확인하였다 (그림 3a). 또한, US9 단백질은 STING 및 TBK1
단백질과 강하게 결합하는 것을 Co-Immunoprecipitation 방법으로 확인할
수 있었으며 (그림 3b), 결과적으로 US9 단백질에 의해 신호전달 과정에 중요한 STING과 TBK1간의 상호작용이 감소하는 것을 확인할 수 있었다 (그림 3c). 추가로 US9 단백질에 의한 MAVS/STING 매개의 신호전달 경로의 억제가 실제로 제1형 IFN 발현에 중요한 IRF3에 영향을 주는지 확인하였다. MAVS 및 STING의 활성화에 의해 IRF3 단백질이 핵으로 이동하지만 US9 단백질이 발현되는 세포에서는 IRF3 단백질이 핵으로의 이동이 감소하였다 (그림 3d). 이러한 결과는 US9 단백질이 STING-TBK1 신호전달 경로 및 IRF3의 위치 변화에 영향을
주고, 결과적으로 STING에 의한 IFN-β 생성을 억제한다는 것을 알 수 있다.
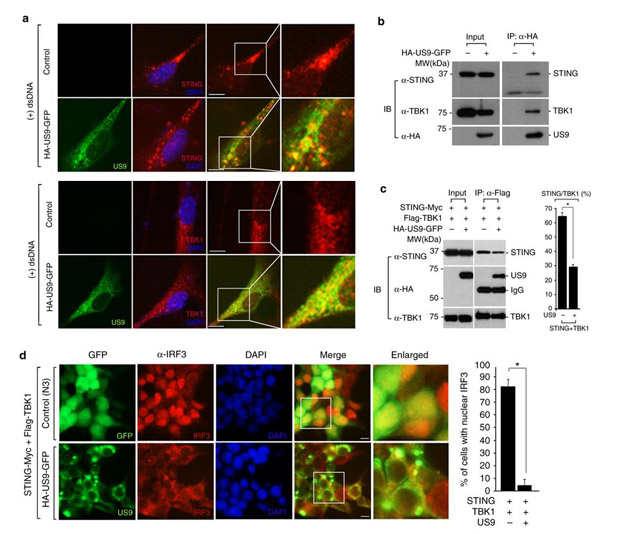
그림 3. US9 단백질에 의한
STING-TBK1 매개의 신호전달 경로 억제 작용
연구의 성과 및 의의
인체는 바이러스 감염 시 항바이러스 면역 반응을 강력하게 유도할 수 있는 핵심 면역 물질인 인터페론(Interferon; IFN)을 분비하여 바이러스의 증식을 억제시키고 숙주의 방어 시스템을 활성화시킨다. 하지만 헤르페스 바이러스와 같은 만성 감염 바이러스는 숙주의 강력한 면역 반응을 무력화시킬 수 있는 다양한
바이러스 단백질을 생성하여 인체 내에서 장기간 생존할 수 있고 이로 인해 암, 퇴행성 신경 질환, 감염 질환 등 다양한 면역 질환을 유도할 수 있다. 현재 세계 인구의
약 60~70% 정도가 HCMV에 감염되어 있고, 특히 면역 발달이 미숙한 신생아 혹은 면역 시스템이 약화된 환자(예를
들어 장기이식 및 AIDS 환자 및 노인 등)에서의 HCMV의 감염은 치명적인 면역 질환을 유도할 수 있다. 하지만 현재 HCMV의 치료용 백신은 개발되지 않았으며, 또한 HCMV의 분자 세포 면역학적 메커니즘의 연구는 매우 부족한 실정이어서 바이러스 진단 및 치료제 개발에 어려움이
있었다. HCMV가 독자적으로 만들어내는 “US9”라는 단백질이
인체 내 항바이러스 활성 기전에 필수적인 Mitochondria 및 ER의
면역 센서를 통한 면역 활성 경로를 선택적으로 방해하여 인터페론 분비를 억제할 수 있는 새로운 바이러스 면역 회피 기전을 최초로 밝혔다 (그림 4). 본 연구 결과를 통해 향후 만성 바이러스 치료제 및 자가면역질환
신약개발에 유용하게 활용될 것으로 기대되며, 또한 만성감염 HCMV의
면역 억제 기전 및 특이적 바이러스 단백질을 이용하여 과도한 면역 활성으로 인해 유도되는 암, 자가면역질환
및 퇴행성 신경 질환 등의 면역 질환 치료제 개발에 중요한 단서를 제공할 것으로 기대된다.
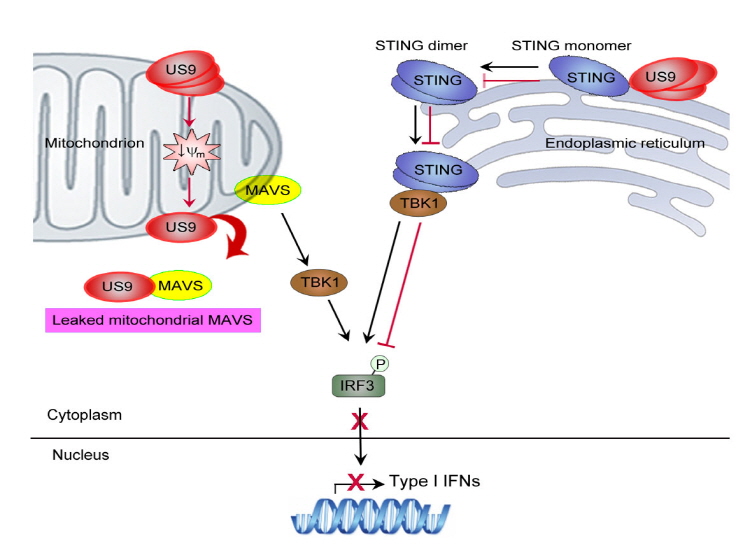
그림 4.
HCMV US9 단백질에 의한 MAVS/STING 매개의 IFN-β 신호전달 경로 억제 모델
참고문헌
1. Takeuchi,
O. and Akira, S. (2010) Pattern recognition receptors and inflammation. Cell 140, 805-820.
2. Ishikawa, H. and Barber, G. N. (2008) STING is an endoplasmic
reticulum adaptor that facilitates innate immune signalling. Nature 455, 674-678.
3. Seth, R. B., Sun, L., Ea, C. K. and Chen, Z. J. (2005)
Identification and characterization of MAVS, a mitochondrial antiviral
signaling protein that activates NF-kappaB and IRF 3. Cell 122, 669-682.
4. Cheng, G., Zhong, J., Chung, J. and Chisari, F. V. (2007)
Double-stranded DNA and double-stranded RNA induce a common antiviral signaling
pathway in human cells. Proc Natl Acad
Sci U S A 104, 9035-9040.
5. Beachboard, D. C. and Horner, S. M. (2016) Innate immune evasion
strategies of DNA and RNA viruses. Curr
Opin Microbiol 32, 113-119.
6. Goubau, D., Deddouche, S. and Reis e Sousa, C. (2013) Cytosolic
sensing of viruses. Immunity 38, 855-869.
7. Wei, C., Ni, C., Song, T., Liu, Y., Yang, X., Zheng, Z., Jia, Y.,
Yuan, Y., Guan, K., Xu, Y., Cheng, X., Zhang, Y., Yang, X., Wang, Y., Wen, C.,
Wu, Q., Shi, W. and Zhong, H. (2010) The hepatitis B virus X protein disrupts innate
immunity by downregulating mitochondrial antiviral signaling protein. J Immunol 185, 1158-1168.
8. Compton, T., Kurt-Jones, E. A., Boehme, K. W., Belko, J., Latz,
E., Golenbock, D. T. and Finberg, R. W. (2003) Human cytomegalovirus activates
inflammatory cytokine responses via CD14 and Toll-like receptor 2. J Virol 77, 4588-4596.
9. Browne, E. P. and Shenk, T. (2003) Human cytomegalovirus
UL83-coded pp65 virion protein inhibits antiviral gene expression in infected
cells. Proc Natl Acad Sci U S A 100, 11439-11444.
10. Weekes, M. P., Tomasec, P., Huttlin, E. L., Fielding, C. A.,
Nusinow, D., Stanton, R. J., Wang, E. C., Aicheler, R., Murrell, I., Wilkinson,
G. W., Lehner, P. J. and Gygi, S. P. (2014) Quantitative temporal viromics: an
approach to investigate host-pathogen interaction. Cell 157, 1460-1472.
첨부파일