
생화학분자생물학회입니다.
APC(Anaphase promoting complex)가 DNA 손상부위에 유비퀴틴 신호를 보호함으로써 손상복구 방식 선택에 영향을 준다
작성자
관리자작성일자
2017-08-01조회수
601APC(Anaphase Promoting Complex)가 DNA 손상부위에 유비퀴틴 신호를 보호함으로써 손상복구 방식 선택에 영향을 준다
The anaphase promoting complex impacts repair choice by protecting ubiquitin signalling at DNA damage sites
Nat Commun 8:15751, 2017
하경수 오송신약개발지원센터
연구배경
세포 내외부로부터의 수많은 공격과 DNA 복제 실수에 의해 발생하는 DNA 손상에 의해 유전체 안정성은 끊임없이 위협을 받는다. 유전체의 안정성에 가장 큰 위협 인자는 Double-Strand Breaks(DSBs)이며 Homology-Directed Recombination(HDR)과 Non-Homologous End Joining(NHEJ)에 의해 복구된다. 이 두 과정 중 어떤 것을 선택할지는 세포주기에 의해 크게 좌우되는데, G1기에는 NHEJ가 주도적으로 일어나고 자매염색분체가 있는 S/G2기에는 HDR 뿐만 아니라 NHEJ에 의한 손상 복구 과정도 가능하다.
자매염색분체가 없는 G1기에는 NHEJ가 우세한 것은 HDR의 핵심과정인 DNA 말단 절단(DSB End Resection)에 필요한 CtIP의 양이 부족할 뿐 아니라 필수 인산화 과정도 일어나지 않아서 HDR 필수 인자인 BRCA1이 NHEJ 인자인 RIF1의 접근을 막을 수도 없기 때문이다. 그러나, S기에는 CtIP가 CDK에 의해 인산화되면서 BRCA1이 DSB에 소환되고 HR을 증진시킨다.
하지만, 이러한 BRCA1과 RIF1 사이의 길항작용에도 불구하고 RIF1 IRIF(Irradiation-Induced Foci)와 BRCA1 IRIF가 여전히 S/G2 세포에서 공존하며, 사실 NHEJ도 HDR 못지않게 활발히 일어난다. 그러면, S/G2기에서 HDR과 NHEJ 중 하나를 선택하는 결정은 누가 하는 것일까? 본 연구에서 복구 과정 선택에 있어 APCCdh1이 결정적인 역할을 한다는 것을 밝혔다. S/G2기에 기본적으로 DSB에 53BP1과 RIF1이 소환되지만, BRCA1은 소환에 필요한 히스톤 폴리유비퀴틴 신호가 탈유비퀴틴 효소인 USP1에 의해 활발하게 분해되기 때문에 DSB에 소환되지 못한다. 하지만 APCCdh1에 의한 USP1의 제거는 반대로 HDR을 촉진시킨다.
연구결과
1. S/G2기 세포에서 RIF1과 BRCA1 IRIF는 공존한다.
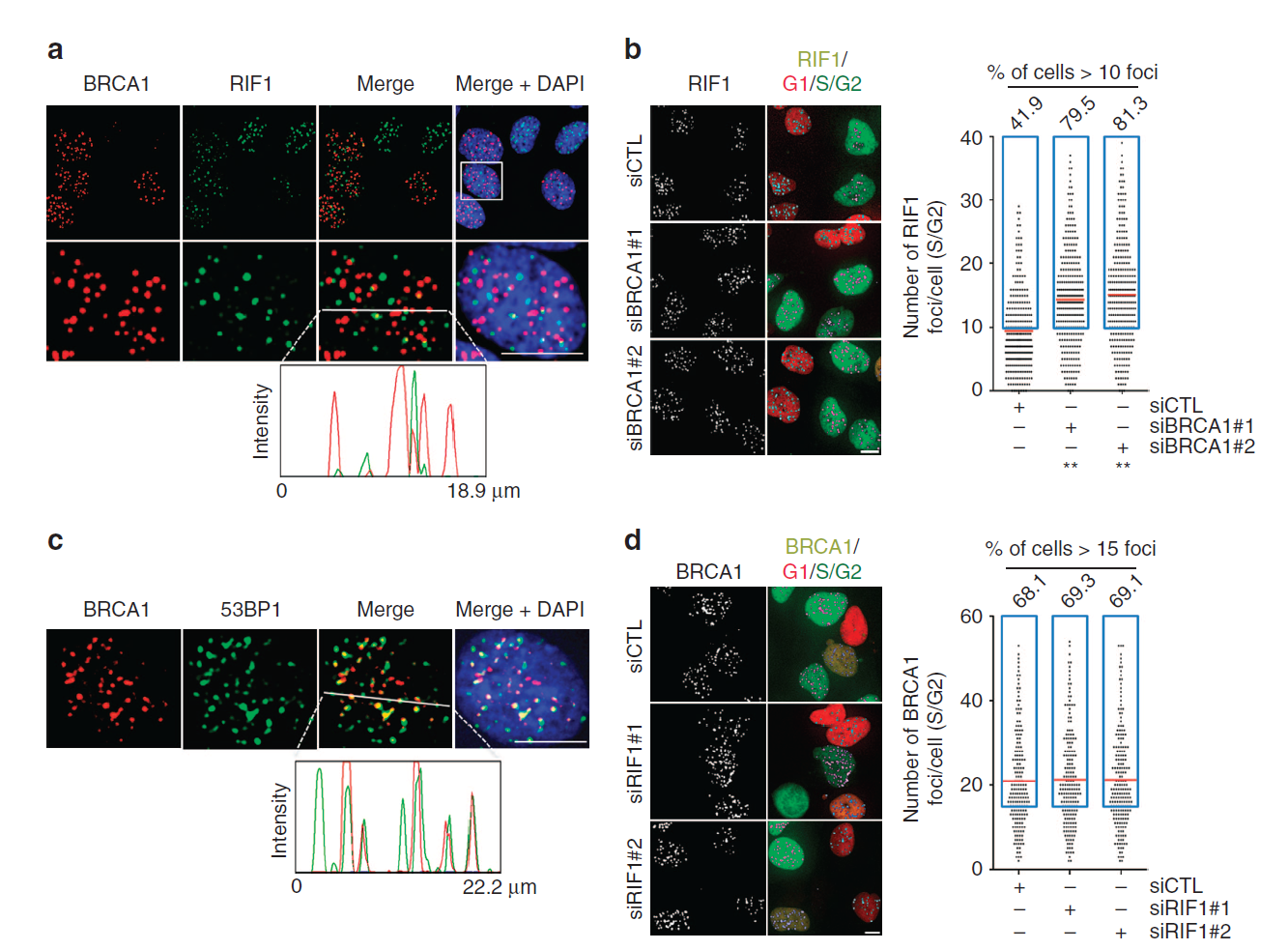
S/G2기 세포에서 RIF1과 BRCA1은 공존한다. RIF1의 소환에 필요한 53BP1 일부 RAD51과 BRCA1과 같은 자리에 위치한다. 하지만 RIF1의 결핍은 BRCA1 foci 수에는 영향을 주지 않는 것은 Pro-NHEJ DSB는 BRCA1과 경쟁하지 않기 때문이다.
S/G2기 세포에서 HDR과 NHEJ 모두가 일어날 수 있다. 실제로 RIF1(NHEJ 표지자)과 BRCA1(HDR 표지자) Foci가 S/G2기에 같은 자리에 있지는 않지만 공존한다.
2. S/G2기 세포의 RIF1 IRIF는 폴리유비퀴틴 신호가 결핍되어 있다.
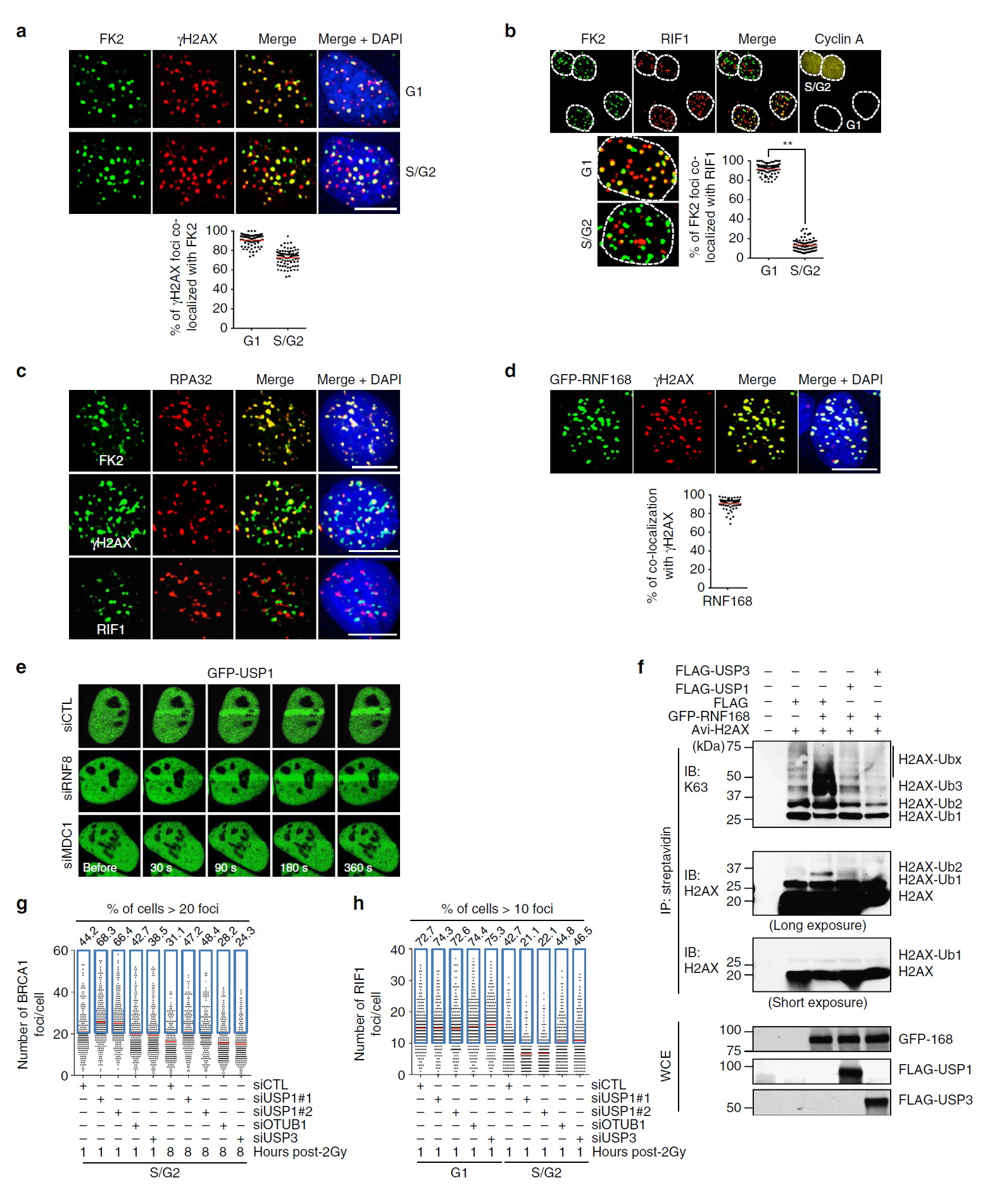
S/G2기 세포의 RIF1 IRIF는 폴리유비퀴틴 신호가 결핍되어 있다. S/G2기에서 DSB는 두 가지 형태의 과정을 거친다. 하나는 폴리유비퀴틴 가지들과 BRCA1 소환(Pro-HDR) 그리고 다른 하나는 BRCA1 소환이 불가능한 형태(Pro-NHEJ)이다. Pro-HDR 자리와 Pro-NHEJ 자리의 비율이 0.90에서 7.0이라는 것은 S/G2기에 HDR이 우세하다는 것을 보여준다. 하지만 이 비율은 U2OS 세포에 국한된 것이고 세포들마다 이 비율은 다양하게 나타난다.
3. USP1은 폴리유비퀴틴의 생성을 막으며, DSB에서 APCCdh1에 의해 분해된다.
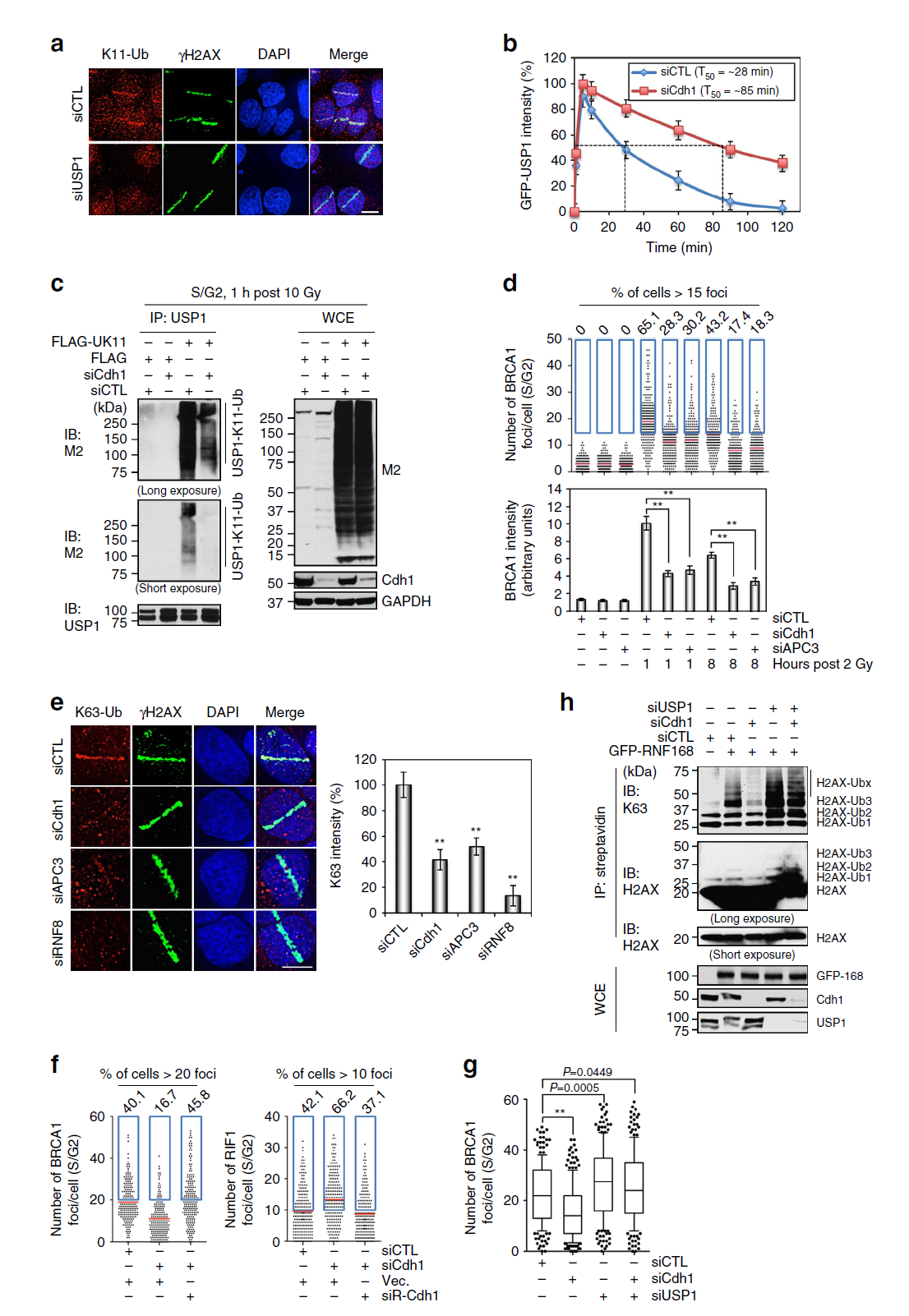
APCCdh1은 USP1을 분해함으로써 NHEJ를 유도한다. USP1 위에 형성된 K11 폴리유비퀴틴 고리는 APCCdh1에 의한 것이다. APC3와 Cdh1의 결핍은 BRCA1 foci를 크게 감소시킬 뿐 아니라, K63에 연결된 유비퀴틴 신호 또한 크게 감소시킨다. Cdh1이 결핍된 세포에서는 H2AX의 유비퀴틴화가 크게 감소했으며 반대로, USP1이 결핍된 세포에서는 크게 증가하였다. USP1의 결핍은 BRCA1 IRIF의 증가를 야기하지만 RIF1 IRIF를 감소시킨다.
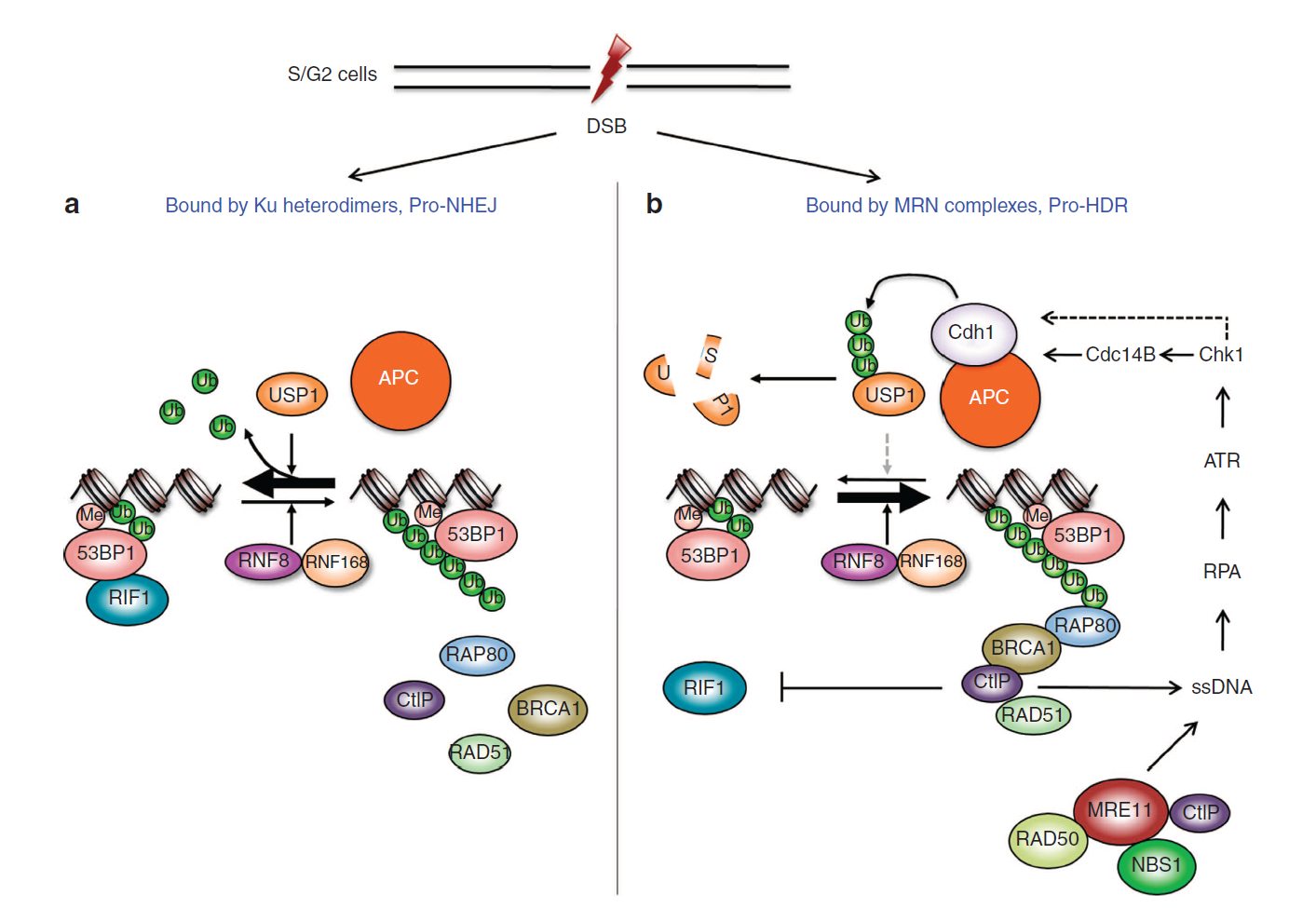
S/G2기 세포에서 USP1과 APC Cdh1에 의한 DSB 복구 과정의 선택 조절 모델.
Ku 이형이량체와 MRN 복합체의 경쟁을 통해 S/G2기 세포의 DSB의 복구가 진행된다. (a) Ku 단백질이 DSB에 결합하면 DNA 손상이 NHEJ에 의해 복구된다. (b) 하지만, MRN 복합체가 결합하게 되면 DSB 말단 절단에 의해 생성된 ssDNA가 ATR, Chk1, APCCdh1을 활성화시켜 결국 USP1을 분해시키고 BRCA1을 소환하게 된다. 그리고 BRCA1은 RIF1의 접근을 막는다.
APCCdh1은 많은 발암 단백질들의 분해하는 역할을 하기 때문에 종양 억제자로 알려져 왔다. 이번 연구를 통해 유전체 안전성 유지 역할을 통해 DSB 복구에도 중요한 역할을 한다는 것을 알 수 있다. 기존에 53BP1이 BRCA1과의 길항작용을 통해 DSB 복구 과정선택을 조절한다고 알려져 왔다. 이번 연구의 또 다른 중요한 발견은 탈유비퀴틴 효소인 USP1 자체의 유비퀴틴에 의한 분해조절이 53BP1과 BRCA1의 상위 단계에서 DSB 복구과정 선택에 결정적인 영향을 미친다는 것이며, 단백질의 번역후변형 과정(Post-Translational Modifications, PTMs) 중 하나인 유비퀴틴화 조절의 중요성을 알 수 있다.
참고문헌
1. Jackson, S. P., Bartek, J. (2009) The DNA-damage response in human biology and disease. Nature 461, 1071–1078.
2. Lieber, M. R. (2010) The mechanism of double-strand DNA break repair by the nonhomologous DNA end-joining pathway. Annu Rev Biochem 79, 181–211.
3. Symington, L. S., Gautier, J. (2011) Double-strand break end resection and repair pathway choice. Annu Rev Genet 45, 247–271.
4. Chapman, J. R., Taylor, M. R., Boulton, S. J. (2012) Playing the end game: DNA double-strand break repair pathway choice. Mol Cell 47, 497–510.
5. Li, M., York, J. P., Zhang, P. (2007) Loss of Cdc20 causes a securin-dependent metaphase arrest in two-cell mouse embryos. Mol Cell Biol 27, 3481–3488.
6. Jin, L., Williamson, A., Banerjee, S., Philipp, I., Rape, M. (2008) Mechanism of ubiquitin-chain formation by the human anaphase-promoting complex. Cell 133, 653–665.
7. Bu, W., Xin, L., Toneff, M., Li, L., Li, Y. (2009) Lentivirus vectors for stably introducing genes into mammary epithelial cells in vivo. J Mammary Gland Biol Neoplasia 14, 401–404.
8. Cotto-Rios, X. M., Jones, M. J., Busino, L., Pagano, M., Huang, T. T. (2011) APC/CCdh1-dependent proteolysis of USP1 regulates the response to UV mediated DNA damage. J Cell Biol 194, 177–186.
9. Zhang, L. et al. (2010) Proteolysis of Rad17 by Cdh1/APC regulates checkpoint termination and recovery from genotoxic stress. EMBO J 29, 1726–1737.
10. Bassermann, F. et al. (2008) The Cdc14B-Cdh1-Plk1 axis controls the G2 DNA damage-response checkpoint. Cell 134, 256–267.
첨부파일