
생화학분자생물학회입니다.
Laboratory of Molecular Mechanism of Cellular Senescence
작성자
관리자작성일자
2016-03-01조회수
539Laboratory of Molecular Mechanism of Cellular Senescence
이재선
인하대학교 의과대학 세포노화분자기전연구실
본 연구실은 암노화 조절 기전 규명 및 신규 조절 분자 발굴 연구를 수행하고 있다. 암노화 분야의 연구는 노화라는 생명현상을 이해하면서 암치료를 위한 임상활용성까지 확보된 매우 흥미로운 연구분야로 최근 세계적으로 매우 각광 받고 있는 연구분야이다 (그림 1).
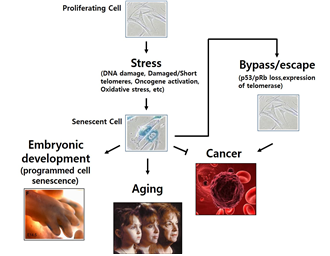
그림 1. 개체 노화, 배발생, 발암억제와 밀접하게 연관되는 세포노화 연구분야
세포노화(Senescence)의 ‘senes’ 라는 라틴어는 늙은 사람이나 노년기를 지칭하는 용어이다. 개체 수준 에서 노화는 발달과 성숙 과정 이후 수반되는 퇴화과정을 의미하고, 세포 수준에서의 노화는 세포분열의 영구적인 중단을 의미한다. 정상세포와는 달리 종양세포들은 종양형성과정(Tumorgenesis)에서 일반적으로 무한정 복제할 수 있는 능력을 획득한 세포로서 노화과정의 활성화가 불가능할 것이라고 일반적으로 생각되어졌지만 1997년 Cell 학술지와 Proc Natl Acad Sci 학술지에 최초로 암세포 노화에 대해 보고된 이후, 현재는 다양한 경로 조절에 의해 암세포에서 노화 조절 유전자들의 발현이 변화되면 노화과정이 유도될 수 있고, 종양세포의 영속성이 소멸될 수 있다고 보고되어지면서 종양치료의 새로운 개념으로 세포노화 기전의 응용이 활발히 대두되고 있으며 암치료의 한 전략으로 암세포노화 유도 치료법도 매우 활발히 제안되고 있다 (그림 2).

그림 2. 발암과정에서 세포노화 기전 활성화와 세포사멸 기전 활성화에 의한 발암억제 기전
한편, 노화된 세포에서 증가하는 다양한 분비체(Secretome) 변화로 인해 주변 조직의 미세환경에 영향을 미쳐 종양형성이 촉진되거나 노화가 유도되는 부정적 작용과 함께 조직재생 등의 긍정적 작용도 최근 보고되고 있기 때문에 이러한 노화세포의 부정적·긍정적 영향을 적절하게 제어하기 위해서는 암세포 노화의 명확한 분자적 기전 연구 및 종양 주변 미세환경의 제어에 따른 암노화 치료 부작용 극복방안의 연구가 함께 수행되어야 한다. 본 연구실은 암세포 노화연구의 초기 시점부터 이 분야의 연구를 시작하였으며 정상세포에서의 텔로미어 손상과 연관되는 복제성 노화와는 차별화되는 암세포 노화 조절 기전 규명을 활발하게 연구하고 있다. 이를 위해서 (1) 방사선이나 항암제 혹은 다양한 외재적·내재적 스트레스에 의한 암세포 노화의 신호전달경로 규명 연구, (2) 유전체 및 단백질체 분석법을 이용한 신규 암세포 노화조절 분자를 발굴하여 이들 분자에 대한 분자적 작용기전 연구, (3) 노화 암세포가 분비하는 분비체에 대한 종양주변환경 영향 규명 연구, (4) 차세대시퀀싱 방법을 활용하여 노화과정 특이적 신규 Noncoding RNA를 발굴하여 이들의 세포 내 기능 연구를 수행하고 있다. 최근에는 인하대학교 의과대학 MRC(기초의학연구센터) 저산소표적질환연구센터 핵심연구실로 (5) 저산소 종양미세환경과 암노화 기전 연관 암치료 저항성 극복 방안 연구도 수행 중에 있다.
[연구 내용]
1. 암세포 노화 신규 조절 분자 발굴 및 분자적 작용 기전 규명
(1) 방사선에 의한 암세포 노화 유도시 JNK 억제제의 방사선 병용처리 효과 및 기전 연구
본 연구진은 암치료시 암노화를 효율적으로 유도할 수 있는 병용약제 및 암노화를 직접적으로 조절할 수 있는 타겟분자 발굴 연구를 수행하였다. 그 중 정상적인 세포 상황에서 JNK 분자는 Bcl2 분자의 인산화를 유지시킴으로써 미토콘드리아로부터 과다한 활성산소 발생을 억제해 세포를 노화 경로 활성화로부터 보호하고 있음을 발견하였다. 또한, JNK 억제제를 처리하거나 Bcl2 인산화를 억제하게 되면 미토콘드리아로부터 활성산소 생성이 증가하면서 암세포노화가 급속히 일어나게 됨을 발견하였습니다. 따라서, 방사선에 의한 암세포 노화 유도시 JNK 억제제를 병용처리하면 암노화가 매우 효과적으로 유도됨을 증명하였다 (그림 3).
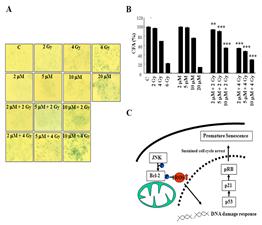
그림 3. Basal JNK 활성에 의한 bcl-2 인산화유지가 세포 내 활성산소 증가를 억제함으로서 세포노화를 억제하고 있음을 보고함(Lee et al. Oncogene. 2010, 29: 561-575).
(2) Wig1 단백질의 분자적 작용기전 및 암노화 조절 기능 연구
본 연구진은 유전체 분석법을 이용하여 암세포 노화조절 후보 유전자군을 다수 확보하였으며, 그 중 세포 내 기능이 밝혀지지 않았던 Wig1의 기능에 대한 연구를 수행 중이다. Wig1 단백질은 RNA 결합단백질로서 RNA에 결합하여 RISC(RNA Induced Silencing Complex)가 타겟 mRNA 분자에 결합이 용이하지 않은 경우 RISC가 타겟 mRNA에 결합할 수 있도록 가이드 역할을 하는 Gene Silencing 과정에 매우 중요한 새로운 기능의 RNA 결합 단백질임을 규명하였다. Wig1 조절을 통해 타겟 mRNA의 한 종류인 p21 mRNA의 양적 조절이 매우 정교하게 일어남으로서 세포노화를 관장하고 있다는 새로운 분자적 기전을 종양이식동물모델과 폐암환자 검체에서 직접 검증하였으며 (그림 4). 현재 Wig1의 다양한 타겟을 추가 발굴하였으며 Wig1이 이들을 타겟을 조절함으로서 세포내 다양한 Gene Silencing 기전과 어떻게 연관되고 있는가에 대한 연구를 수행 중에 있다.
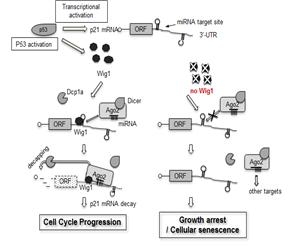
그림 4. Wig1에 의한 p21 mRNA 안정성 조절이 세포노화 제어에 필수적임을 규명함(Kim et al. EMBO J. 2012, 31:4289-4303)
(3) PAPSS2 단백질의 분자적 작용기전 및 암노화 조절 기능 연구
유전체 분석법을 이용하여 확보된 암세포 노화조절 후보 유전자군 중 PAPSS2 유전자의 기능 연구를 수행 중이다. PAPSS2는 세포의 황산화(Sulfation) 과정에 필수적인 Sulfur Donor를 합성하는 효소로 막당단백의 황산화에 주요한 영향을 미치는 단백질이다. 본 연구실에서는 PAPSS2 유전자 발현을 억제할 경우, 다양한 막수용체 중 FGFR의 과도한 활성화에 따른 하위단백질 AKT의 과활성화와 p53과 p21의 과다한 축척을 확인하였으며 이들 상호간의 분자적 신호전달경로를 확인하였다. 특히 막당단백의 2‘-O 위치의 황산화가 FGFR 막수용체 활성 조절에 매우 중요하게 작용하여 이를 통한 AKT 활성의 정교한 조절이 세포증식에 필수적으로서 불완전한 막당단백의 황산화는 이들 신호전달경로를 과다하게 활성화하여 세포노화를 유도한다는 연구결과를 보고하였다 (그림 5).
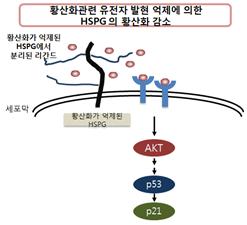
그림 5. 막당단백의 황산화 억제에 의한 암세포 노화 유도의 분자적 기전을 규명함(Jung et al. CDD. 2016, in press)
(4) 다양한 암노화 제어 신호전달경로에 대한 연구
위에서 기술한 연구 이외에도 암노화 활성화과정에서의 지질래프트 역할 규명, 암노화 유도시 p53 및 상하위 연관 분자 기능 규명, 혈관노화와 종양주변환경 영향 규명 등과 관련된 신호전달경로에 대한 연구를 수행 중이다.
2. 암노화 제어를 위한 Noncoding RNAs 발굴 및 작용 기전 연구
30억개의 염기쌍으로 구성된 인간 게놈은 약 2% 만이 단백질을 코우딩하는 mRNA이며 90% 정도는 단백질을 합성하지 않고 전사되고 있음이 보고되었고 이러한 부위를 ncRNA(noncoding RNA)라고 한다. ncRNA는 단순한 '전사 noise'가 아니라 세포 내에서 명백하고도 중요한 기능을 수행하고 있음이 최근 일련의 연구들에서 증명되고 있다 (그림 6). 본 연구진은 최근까지 암노화 분야에서 연구가 매우 미흡한 ncRNAs에 대한 연구를 수행하고 있다. 암노화를 제어할 수 있는 신규 ncRNAs 타겟을 발굴하고 이들에 의한 암노화 조절 기전을 규명하기 위해 노화된 암세포에서 microRNAs (miRNAs) 및 long noncoding RNAs(lncRNAs) 발현 변화 프로화일 분석을 통해 암노화를 제어할 수 있는 신규 타겟 miRNAs와 lncRNA를 발굴하였으며, 발굴 신규 타겟 분자들의 분자적 작용기전 및 이들에 의한 암세포 노화 연관 신호전달경로를 규명하고 이들 타겟 분자들의 작용기전이나 신호전달 경로를 제어함으로서 암노화를 제어하는 연구를 수행 중이다.
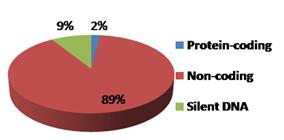
그림 6. Characterization of human genome
3. 저산소암노화 및 저산소 종양미세환경 연구
본 연구실은 MRC “저산소표적질환연구센터” 핵심연구실로 저산소 종양미세환경과 연관된 암치료 저항성 극복 연구를 수행하고 있다. 최근 질병의 진단·치료 기술이나 신약개발 시 세포 자체에 대한 영향뿐만 아니라 주변 미세환경과의 상호작용에 의한 생체반응 시스템을 포괄적으로 이해하는 것이 중요하다. 특히, 종양의 내부는 중증 저산소 미세환경으로서 저산소 미세환경에 의해 암세포의 노화 진행이 저해되는데, 저산소 미세환경 내 암 노화 연관 연구는 거의 진행되고 있지 않다 (그림 7). 따라서 중증 저산소 미세환경내 암세포 증식을 제어하기 위한 암세포 노화촉진 전략은 암세포 노화연구의 필수적인 연구분야이다. 현재 본 연구실은 저산소 환경에서 세포노화 억제기전과 암노화 저항성 극복을 위해 저산소에서 암 노화유도 시 조절되는 물질 중 노화의 진행에 영향을 주는 신규물질을 발굴하고, 신규물질에 의한 노화 억제 기전을 연구하고 있다.
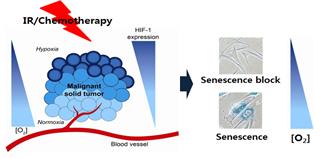
그림 7. 저산소 미세환경에 의한 항암제 및 방사선에 의한 암세포 노화 영향 연구 수행 중
[연구책임자]

이재선 교수
인천광역시 남구 인하로 100 인하대학교 60주년 기념관 1009호
전화: 032-860-9831
E-mail: jaeslee@inha.ac.kr
[연구진 구성]



연구교수 박사후 연구원 박사과정
정승희 이형철 황현정


석사후 연구원 학부연구원
강동희 박현아
[대표논문]
1. Hwang, H.J., Jung, S.H., Lee, H.C., Han, N.K., Bae, I.H., Lee, M.Y., Han, Y.H., Kang Y.S., Lee S.J., Park, H.J., Ko, Y.G.,
Lee, J.S. (2016) Identification of novel therapeutic targets in the secretome of ionizing radiation-induced senescent tumor
cells. Oncol Rep. 35, 841-850.
2. Jung, S.H., Lee, H.C., Yu, D.M., Kim, B.C., Park, S.M., Lee, Y.S., Park, S.M., Lee, Y.S., Park, H.J., Ko, Y.G., Lee, J.S.
(2015) Heparansulfation is essential for the prevention of cellular senescence. Cell Death and Differentiation. 7
doi:0.1038/cdd.2015.107. [Epub ahead of print].
3. Kim, B.C., Lee, H.C., Lee, J.J., Choi, C.M., Kim, D.K., Lee, J.C., Ko, Y.G., Lee, J.S. (2012) Wig1 Prevents Cellular
Senescence by Regulating p21 mRNA Decay through Control of RISC Recruitment. EMBO J. 31, 4289-4303.
4. Han, N.K., Kim, B.C., Lee, H.C., Lee, Y.J., Park, M.J., Chi, S.G., Ko, Y.G., Lee, J.S. (2012) Secretome analysis of ionizing
radiation-induced senescent cancer cells reveals that secreted RKIP plays a critical role in neighboring
cell migration. Proteomics. 12, 2822-2832.
5. Lee, J.J., Kim, B.C., Park, M.J., Lee, Y.S., Kim, Y.N., Lee, B.L., Lee, J.S. (2011) PTEN status switches cell fate between
premature senescence and apoptosis in glioma exposed to ionizing radiation. Cell Death & Differentiation. 18, 666-677.
6. Lee, J.J., Lee, J.H., Ko, Y.G., Hong, S.I., Lee, J.S. (2010) Prevention of premature senescence requires JNK regulation of
Bcl-2 and reactive oxygen species. Oncogene. 29, 561-575.
7. Byun, H.O., Han, N.K., Lee, H.J., Kim, K.J., Ko, Y.G., Yoon, G., Lee, Y.S., Hong, S.I., Lee, J.S. (2009) Cathepsin D and
Eukaryotic Translation Elongation Factor 1 as Promising Markers of Cellular Senescence. Cancer Research. 69, 4638-4647.