
생화학분자생물학회입니다.
호중구 세포외덫 형성 저해 및 CXCR2의 감소를 통한 포스포리파제 D2의 패혈증 병리에서의 기능 규명
작성자
관리자작성일자
2016-04-01조회수
776호중구 세포외덫 형성 저해 및 CXCR2의 감소를 통한 포스포리파제 D2의 패혈증 병리에서의 기능 규명
Phospholipase D2 drives mortality in sepsis by inhibiting neutrophil extracellular trap formation and down-regulating CXCR2. JEM 212: 1381-1390, 2015.


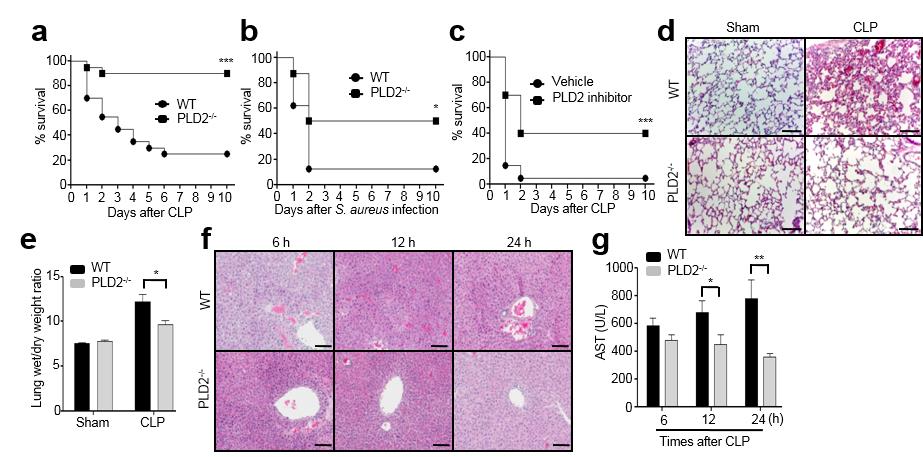
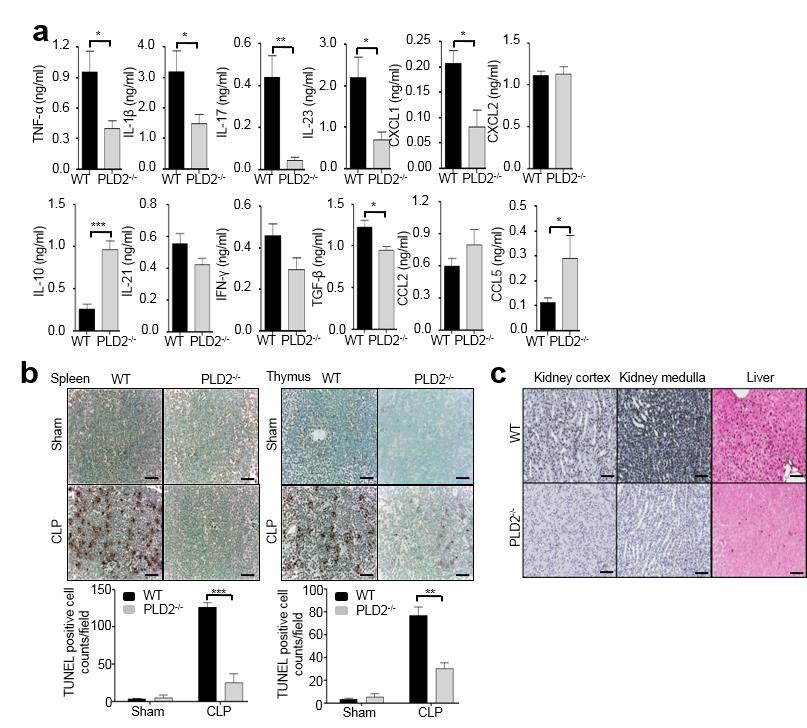

그림 3. 패혈증 유도된 PLD2 결핍 쥐는 살균작용 및 NET 형성을 증가시킨다. (a-e) 패혈증 유도된 Wild Type 및 PLD2 결핍 쥐에서의 복강 세척액, 혈액, 기관지 세척액, 간, 비장, 폐를 추출하여 Blood Agar Plate에서의 집락형성단위(CFUs)를 확인하였다 (a). 복강에서의 호중구(Ly6G+) 수를 확인하였다 (b). 복강에서의 히스톤 3 시트르린화를 확인하였다 (c). 폐에서의 호중구 및 히스톤 3 시트르린화를 공초점 현미경을 통하여 확인하였다 (d). 폐에서의 PAD 활성을 확인하였다 (e). (출처: Lee et al., JEM 212: 1381-1390, 2015.)
4. CXCR2조절에 의한 호중구 이동성에서의 PLD2의 역할
PLD2 결핍 쥐에서 패혈증 발병 후 감염부위로의 많은 수의 호중구가 이동해 오며 세균 집락형성단위가 줄어듦을 확인하였다. CXCR2는 감염부위로의 호중구 이동성에 매우 중요한 세포표면 수용체로 알려졌으며 패혈증 환자에서는 크게 감소되어 있음이 알려졌다. 이에 PLD2 결핍 호중구에서 CXCR2 수용체 발현여부를 확인하였다.
PLD2 결핍쥐에서 기관지로의 호중구 이동이 증가됨을 확인하였으며, 세포표면에서의 CXCR2 수용체 발현이 증가됨을 확인하였다. CXCR2 수용체 발현과 관련된 신호전달 체계에서 G-Protein Coupled Receptor Kinase 2(GRK2) 활성은 매우 중요하다. Lipopolysaccharide(LPS)에 자극에 의해 GRK2 활성이 증가되며 결과적으로 세포표면에 존재하는 CXCR2의 내제화가 증가된다. LPS자극에 의해 증가되는 GRK2 발현이 NF-κB 신호전달 경로를 통해서 매개되며, PLD2 결핍 호중구에서는 GRK2 발현이 현저히 감소됨을 확인하였다. 그렇다면 패혈증 치료효과를 나타내는 PLD2 결핍 쥐에 CXCR2 길항물질을 처리할 경우 PLD2에 의한 치료효과를 저해하는지 실험하였다. 결과적으로 PLD2 결핍에 의한 패혈증 치료효과가 CXCR2 길항물질처리에 의해 저해됨을 확인하였다.
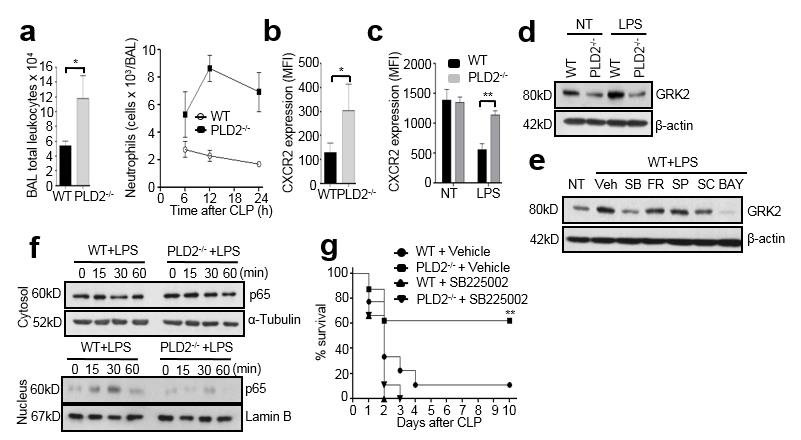
그림 4. 패혈증 과정에서 PLD2는 CXCR2를 감소시킴으로써 호중구 이동을 저해한다. (a, b) 패혈증이 유도된 Wild Type 및 PLD2 결핍 쥐에서의 기관지 세척액을 얻어 전체 백혈구 및 호중구를 유동 세포 분석법을 통하여 확인하였다 (a). (c-f) Wild Type 및 PLD2 결핍 쥐에서의 분리한 호중구를 LPS로 자극을 준 후 표면에 존재하는 CXCR2 수용체를 유동 세포 분석법을 통하여 확인하였다 (b, c). SB203580, FR180204, SP600125, SC-514 또는 BAY11-7082 처리 후 GRK2 발현 수치를 특수 단백질 검출 검사법을 이용하여 확인하였다 (d, e). 세포질의 p65와 핵에서의 p65발현 양상을 특수 단백질 검출 검사법을 이용하여 확인하였다 (f). 패혈증 모델 만들기 2시간전 CXCR2 길항제 SB225002 또는 Vehicle 주입 후 생존율을 10일간 관찰하였다 (g). (출처: Lee et al., JEM 212: 1381-1390, 2015.)
5. PLD2결핍 호중구의 중요한 역할을 통한 패혈증 치료효과를 확인
패혈증 유도에 의한 사망률 및 과도한 면역반응은 PLD2 결핍에 의해 감소함을 확인하였다. 그렇다면 PLD2가 결핍된 호중구에 의한 패혈증 치료효과인지 확인하기 위해 Anti-Ly6G Antibody를 이용하여 호중구 제거 후 Wild Type쥐의 호중구와 PLD2 결핍 쥐의 호중구를 각각 Wild Type쥐에 면역세포를 이입하여 패혈증 모델을 유도하였다. PLD2 결핍 호중구가 이입된 Wild Type쥐에서 살균작용이 더 높았으며 폐 감염 및 면역세포의 사멸이 높게 감소되었음을 확인하였다. 또한 흥미롭게도 PLD2 결핍 호중구는 Wild Type 호중구보다 더 많은 수의 호중구가 감염부위로 이동함을 확인하였다. 결과적으로 PLD2 결핍에 의한 패혈증 치료효과는 호중구의 세균작용 및 이동성의 증가에 의한 것임을 증명하였다.
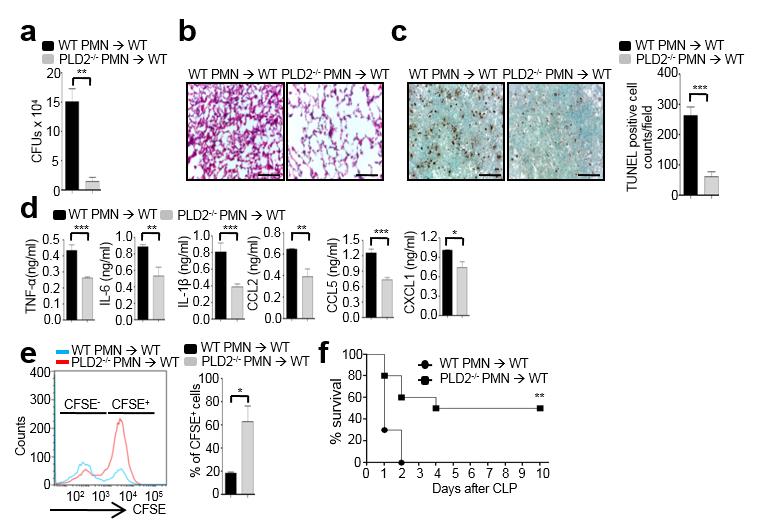
그림 5. PLD2 결핍 호중구 이입에 의한 패혈증 치료효과를 높인다. (a-f) Wild Type쥐의 호중구와 PLD2 결핍 쥐의 호중구를 분리 후 각각 Wild Type쥐에 호중구를 이입하여 패혈증 모델을 유도하였다. 복강 세척액을 추출하여 Blood Agar Plate에서의 집락형성단위(CFUs)를 확인하였다 (a). 폐와 비장을 추출하여 H&E Staining(핵 및 세포질 염색)을 통하여 관찰하였다 (b). 면역세포 사멸을 관찰하기 위해 TUNEL Assay기법을 이용하였다 (c). 복강 세척액을 통하여 사이토카인을 측정하였다 (d). 각각의 호중구에 CFSE 표시 후 기관지 세척액에서 CFSE표시 세포를 유동 세포 분석법을 통하여 확인하였다 (e). Wild Type쥐의 호중구와 PLD2 결핍 쥐의 호중구를 분리 후 각각 Wild Type쥐에 양자면역세포를 이입하여 패혈증 모델을 유도 후 생존율을 10일간 관찰하였다 (f). (출처: Lee et al., JEM 212: 1381-1390, 2015.)
연구의 성과 및 의의
미국에서만 연간 약 80만명의 환자가 발생하며, 사망률이 약 27%에 달할 정도로 심각한감염질환인 패혈증을 효과적으로 치료할 수 있는 치료제 개발을 위해서는 패혈증 병리에 대한 연구가 필요한 실정이다. 본 연구는 패혈증 동물 모델을 이용하여 PLD2가 패혈증 병리 조절에서 중요하게 작용하고 있음을 규명하였다. 패혈증은 다양한 감염균의 감염에 의해 유발되는 전신성 염증반응으로 감염균을 제거하기 위해서는 다양한 종류의 면역세포들의 효과적인 활성화가 필수적이다. 본 연구에서는 패혈증 동물모델에서 PLD2가 호중구가 병원균을 효과적으로 제거하는 데 중요한 기전인 NET 형성을 저해함으로써 호중구에 의한 살균작용을 저해하여 궁극적으로 개체가 사망하게 되는데 기여함을 규명하였다. 이러한 PLD2에 의한 NET 형성 저해에 관련된 작용기전으로 PLD2가 PAD 활성 저해를 통해서 히스톤 시트리린화를 저해할 수 있음을 확인하였다. 아울러, 감염균의 침입에 의해 균의 내독소의 일종인 LPS에 의해서 호중구 이동에서 핵심기능을 담당하는 CXCR2가 감소되는 과정을 PLD2가 매개함을 규명하였다. 한편, PLD2에 의한 LPS-유도 CXCR2 감소에 관련된 분자기전으로 NF-κB 활성화와 이를 통한 GRK2의 활성기전을 규명하였다. 본 연구결과는 아직까지 효과적인 치료제 개발이 전혀 이뤄지고 있지 않는 패혈증에 대한 치료제 개발에 PLD2가 중요한 표적분자가 될 수 있음을 규명한 것으로 중요한 의의가 있다.
참고문헌
1. Angus, D.C., Linde-Zwirble, W.T., Lidicker, J., Clermont, G., Carcillo, J., and Pinsky, M.R. (2001) Epidemiology of severe
sepsis in the United States: analysis of incidence, outcome, and associated costs of care. Crit. Care Med. 29, 1303–1310.
2. Hotchkiss, R.S., Monneret, G. and Payen, D. (2013) Sepsis-induced immunosuppression:from cellular dysfunctions to
immunotherapy. Nat. Rev. mmunol. 13, 862–874.
3. Alves-Filho, J.C., Sonego, F., Souto, F.O., Freitas, A., Verri Jr., W.A., Auxiliadora-Martins, M., Basile-Filho, A., McKenzie, A.N.,
Xu, D., Cunha, F.Q. and Liew, F.Y. (2010) Interleukin-33 attenuates sepsis by enhancing neutrophil influx to the site of
infection. Nat. Med.16, 708–712.
4. Cummings, C.J., Martin, T.R., Frevert, C.W., Quan, J.M., Wong, V.A., Mongovin, S.M., Hagen, T.R., Steinberg, K.P. and
Goodman, R.B. (1999) Expression and function of the chemokine receptors CXCR1 and CXCR2 in sepsis. J. Immunol. 162,
2341–2346.
5. Brinkmann, V., Reichard, U., Goosmann, C., Fauler, B., Uhlemann, Y., Weiss, D.S., Weinrauch, Y. and Zychlinsky, A. (2004)
Neutrophil extracellular traps kill bacteria. Science 303, 1532–1535.
6. Jang, J.H., Lee, C.S., Hwang, D. and Ryu, S.H. (2012) Understanding of the roles of phospholipase D and phosphatidic acid
through their binding partners. Prog. Lipid Res. 51, 71–81.
7. Wang, Y., Li, M., Stadler, S., Correll, S., Li, P., Wang, D., Hayama, R., Leonelli, L., Han, H., Grigoryev, S.A. et al. (2009)
Histone hypercitrullination mediates chromatin decondensation and neutrophil extracellular trap formation. J. Cell Biol. 184, 205–
213.
첨부파일