
생화학분자생물학회입니다.
뇌 기능을 매개하는 핵심 억제성 시냅스 조절자 연구 (Inhibitory Synapse Organizers in Brain Functions and Dysfunctions)
작성자
고재원(연세대학교)작성일자
2015-08-01조회수
965
뇌 기능을 매개하는 핵심 억제성 시냅스 조절자 연구
(Inhibitory Synapse Organizers in Brain Functions and Dysfunctions)

고재원
연세대학교 생명시스템대학 생화학과
jaewonko@yonsei.ac.kr
우리나라의 경우 지난 2000년에 65세 노인 인구가 전체인구의 7%를 넘어서며 고령화 사회에 진입했으며, 이에 따라 삶의 질 향상과 사회문제 해결에 큰 관심이 고조되고 있다. 특히 2026년에는 노인 인구가 20%를 넘어 초고령 사회에 도달할 것으로 예측된다. 이에 따라 각종 노인성 질환 문제가 심각하게 대두될 것으로 예상된다. 특히 노화에 따른 신경퇴화와 유전적/환경적 요인들로 인해 생기는 퇴행성 뇌질환의 경우 만성적으로 진행되어 기억, 판단, 언어능력 등 지적기능이 쇠퇴하고 다양한 행동양상의 장애를 보인다. 영화 ‘내 머리 속의 지우개’에서 알츠하이머 치매를 앓고 점점 죽어가는 아내의 모습을 보면 뇌질환을 앓고 있는 환자 가족들의 슬픔과 좌절감을 조금이나마 짐작할 수 있다. 이러한 뇌질환들을 고칠 수 있는 근본적인 치료제는 있을까? 이에 대한 답을 제공하기 위해서는 어떻게 뇌질환이 발생하는지 이해하는 것이 선행되어야 한다. 하지만 아직까지 현대 신경과학은 이에 대한 명확한 답을 내놓지 못하고 있는 실정이다. 분명한 점은 뇌질환의 발병원인을 규명하기 위해서는 뇌가 어떻게 작동하고 기능을 수행하는지 이해하는 것이 필수적이며, 이에 대한 이해 없이 치료제 개발은 절대 실현할 수 없다는 것이다.
뇌기능을 이해하기 위해서 뇌의 기본적인 기능단위인 시냅스(Synapse)를 이해하는 것이 중요하다. 시냅스는 신경세포 사이의 대화창구로서 기본적인 신경전달(Synaptic Transmission)이 일어나는 곳이다. 이러한 시냅스는 신경세포 사이에 전달되는 신경정보(Neural Information)를 단순히 전달할 뿐만 아니라 상황에 맞추어서 정보를 수정하고 변경하기도 하며, 뇌발달, 기억 및 학습 등의 뇌기능을 매개한다. 본 총설에서는 시냅스 발달에 기여하는 주요 핵심 시냅스 단백질들에 대해서 논의하고 이들 단백질들의 기능에 문제가 생길 경우 발생할 수 있는 뇌질환들에 대해서 간략히 기술하고자 한다. 특히 상대적으로 많이 알려져 있지 않은 억제성 시냅스 단백질들에 대해서 최근 진행되어 온 연구결과들을 중심으로 논의하고자 한다.
2. 본론
2-1. 시냅스: 흥분성 시냅스와 억제성 시냅스
시냅스는 서로 다른 신경세포들 사이의 작은 공간(중추신경계의 경우 약 15-25nm 두께)을 두고 한 쪽 신경세포에서 신경전달물질들이 분비되어 다른 쪽 신경세포에서 이를 수용하는 장소를 통칭한다. 이러한 시냅스는 형태학 및 기능적 특성에 따라서 크게 흥분성 시냅스(Excitatory Synapse)와 억제성 시냅스(Inhibitory Synapse)로 구분된다. 흔히 흥분성 시냅스의 경우 글루탐산(Glutamate)이, 억제성 시냅스는 가바(GABA) 혹은 글라이신(Glycine)과 같은 신경전달물질들이 관여한다. 이들 시냅스는 서로 길항적으로 작용, 뇌의 흥분성 및 억제성(Excitation-to-Inhibition) 균형을 유지하여 뇌기능이 원활하게 유지되도록 작동한다.
이들 시냅스를 형성하는 시냅스 단백질들도 지난 30여 년간 수많은 연구결과들에 의해서 현재까지 약 500-1000여 종이 알려져 있다 (1). 서로 기능이 다른 만큼 각각의 시냅스 형태는 구성 단백질 성분도 다른데, 예를 들면 PSD-95 단백질은 흥분성 시냅스에만 특이적으로 존재하나 Gephyrin 단백질은 억제성 시냅스에만 특이적으로 존재한다. 이를 반영하듯 각각의 단백질은 흥분성 및 억제성 시냅스 단백질의 구조, 기능 및 가소성(Plasticity)을 조절하는 핵심인자로 그 기능이 비교적 잘 확립되어 있다. 물론 Neuroligin-3 단백질과 같이 흥분성 및 억제성 시냅스에 모두 존재하는 단백질들도 상당수 존재한다. 각각의 시냅스 형태에 존재하는 구성 단백질들을 찾고자 하는 연구는 지난 30여 년간 꾸준히 이루어졌으나 상당부분 흥분성 시냅스에 초점이 맞추어져 있었다. 가장 큰 이유는 흥분성 시냅스 단백질들을 동정하는 생화학적 방법 등이 잘 확립되어 있고, 실제 뇌에 흥분성 시냅스의 숫자가 억제성 시냅스의 숫자보다 많은 것도 비교적 용이하게 흥분성 시냅스에 존재하는 단백질들의 동정을 가속화시켰을 것으로 예측된다. 상기 언급한 Gephyrin 단백질 이외에도 최근 Proteomics 등의 방법으로 억제성 시냅스 구성 단백질들도 조금씩 알려지기 시작하였으나, 아직까지 대부분 이들 단백질들의 시냅스 기능은 잘 알려져 있지 않다 (그림 1).
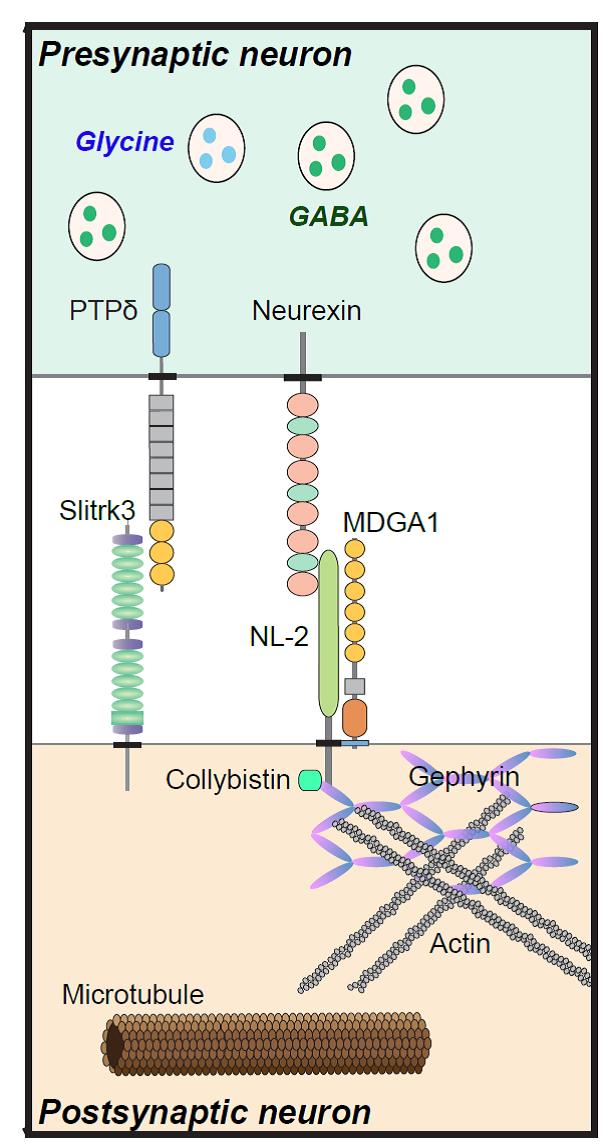
그림1. 억제성 시냅스 모식도
억제성 시냅스의 주요 신경전달물질은 GABA(녹색)와 Glycine(파란색), 전시냅스 신경세포에서 분비하여 후시냅스 신경세포의 수상돌기 Shaft 혹은 세포체에서 발현하는 수용체(GABA Receptor and Glycine Receptor)들에 결합한다. 주요 억제성 시냅스 조절인자들을 표기하였다: 여기에는 시냅스 접착단백질, Scaffold, 신호 단백질 등이 포함되어 있으며 특정 단백질-단백질 상호작용은 각각의 단백질들을 겹치게 표기하였다. 아직까지도 신경세포 내 억제성 시냅스의 대부분 신호전달 기전은 잘 알려져 있지 않다 (modified from Ko et al. Trends in Molecular Medicine 2015).
2-2. 억제성 시냅스 조절자 단백질에 의한 시냅스 발달 조절
억제성 시냅스는 Type II 시냅스로 구분되며 주로 신경세포의 세포체(Soma) 및 수상돌기의 Shaft 부위에 형성된다 (2). 뇌 발달과정이 진행되면서 다양한 형태의 억제성 신경세포(Inhibitory Interneuron)들이 만들어지는데, 이들 억제성 신경세포들은 다양한 형태학적, 전기생리학적 및 신경생화학적 특징들이 있어서 타겟 신경세포들을 특이적으로 인식하여 억제성 시냅스 형성 및 발달과정을 조절한다. 이렇게 억제성 시냅스의 선택적인 연결형태 및 특성화를 매개하는 핵심단백질들을 억제성 시냅스 조절자 단백질(Inhibitory Synapse Organizer)라고 통칭한다 (3). 억제성 시냅스 조절자 단백질들은 흥분성 시냅스 조절자 단백질들과 협력하여 뇌의 흥분성 및 억제성 균형을 유지하는데 중요한 기능을 수행한다. 억제성 시냅스 조절자들의 기능이 망가질 경우 뇌의 흥분성이 급격하게 증가하여 관련 시냅스 및 신경회로의 활성에 이상이 생겨 뇌질환 발병을 유도한다. 이렇듯 시냅스 조절자들의 기능에 이상이 생겨서 생기는 각종 뇌질환들을 통칭하여 ‘시냅스 유래 뇌질환(Synaptopathy)’라고 한다 (4). 억제성 시냅스 조절자들은 핵심 시냅스 발달과정(예를 들면 시냅스 접착이나 신호전달 기전 등)을 조절하며, 다양한 종류의 억제성 시냅스 단백질들을 망라한다. Neuroligin-2와 Slitrk3와 같은 억제성 시냅스에 특이적으로 존재하는 접착단백질들과 Gephyrin, Collybistin, BRAG3/IQSEC3와 같은 Scaffolding 및 신호전달 관련 단백질들이 억제성 시냅스 조절자 단백질들의 범주에 들어간다 (3). 본 총설에서는 최근 연구가 활발히 진행되어 그 기능이 상대적으로 잘 확립되어 있는 Neuroligin-2, Slitrk3, Gephyrin, Collybistin, 그리고 NPAS4 단백질들에 보다 초점을 두고 논의하고자 한다.
(1) Neuroligin-2
Neuroligin-2(NL-2) 단백질은 다양한 시냅스 접착단백질들과 Scaffolding 단백질들과 결합하여 신경세포 활성에 따라 억제성 시냅스 발달을 촉진하는 대표적인 시냅스 접착단백질이다. 다른 Neuroligin군 단백질들과는 달리 억제성 시냅스에만 특이적으로 존재하며, Gephyrin 및 Collybistin과 직접 상호작용하여 GABA 수용체의 Clustering을 조절하고 다른 후시냅스 단백질들을 recruit한다 (5). NL-2 낙아웃 생쥐의 경우 억제성 시냅스 신경전달이 저해되는데 특이하게도 세포체 근처(Perisoma)에 주로 형성되는 억제성 시냅스 숫자 및 신경전달 효율이 감소한다 (6). 즉, 특정 억제성 신경세포(Parvalbumin-Positive Interneuron)에 의해서 전달되는 정보가 선택적으로 저해됨으로써 특정 신경회로의 활성에 NL-2 단백질과 결합 단백질들간의 상호작용이 관여함을 시사하는 것이라고 말할 수 있다.
(2) Slitrk3
Slitrk 단백질은 리간드인 LAR-RPTPs(Leukocyte Common Antigen-Related Receptor Protein Tyrosine Phosphatases)와 함께 흥분성 및 억제성 시냅스 발달을 매개한다 (7-9). 특히 Slitrk3 단백질의 경우 억제성 시냅스에 특이적으로 존재하며 PTPδ 단백질과 결합하여 억제성 시냅스 발달을 매개하는 것으로 알려져 있다. Slitrk3 단백질이 결핍된 형질전환생쥐를 관찰해보면 억제성 시냅스 숫자와 신경전달이 감소되어 있다 (7). 흥미롭게도 Slitrk3와 PTPδ 단백질 모두 강박증(Obsessive-Compulsive Disorder; OCD)과 임상적으로 연관되어 있다 (10). 최근 Slitrk1과 PTPδ 단백질 복합체 구조가 보고되었는데, 이를 바탕으로 Slitrk1에 의한 전시냅스 분화(Presynaptic Differentiation)과정이 두 단계로 진행됨이 알려졌다 (11). 이러한 구조연구를 통해서 Slitrk3단백질과 리간드 간의 상호작용을 선택적으로 억제한 형질전환생쥐의 제작이 가능할 것으로 생각되며, 이를 활용하여 억제성 시냅스 발달과정의 자세한 분자기전도 자세히 밝혀질 것으로 기대된다. 아울러 OCD와 같은 Slitrk3 기능이상과 연관된 뇌질환 발병기전도 규명될 것이다.
(3) Gephyrin & Collybistin
억제성 시냅스의 대표적인 Scaffold 단백질인 Gephyrin은 Glycine 수용체와 GABA 수용체의 Clustering 및 억제성 시냅스 신경전달, 가소성 등을 조절하는 핵심 인자로 잘 알려져 있다 (12). Collybistin 단백질은 Cephyrin 및 Neuroligin-2 단백질과 상호작용하여 억제성 시냅스 발달에 관여한다 (12). 특히 뇌에 존재하는 Collybistin Isoform의 경우 N-terminal 부위에 있는 SH3 도메인에 의해서 Closed Conformation 형태를 띄고 있는데, NL-2 단백질이 결합할 경우 Open Conformation으로 전환되어 억제성 시냅스 분화를 유도한다 (12). 따라서 Collybistin 단백질은 시냅스 접착과 Scaffold Recruitment을 매개하는 핵심 억제성 시냅스 조절자이다.
(4) NPAS4
NPAS4(Neuronal PAS Domain Protein 4) 단백질은 신경활성에 의존적으로 발현이 조절되는 Immediate Early Gene(IEG)으로 대표적인 억제성 시냅스 조절자이다. NPAS4 단백질이 낙다운(Knockdown) 될 경우 억제성 시냅스 숫자가 선택적으로 감소한다 (13). Npas4의 전사인자로서 수많은 단백질들의 발현수준을 조절하는데, 이 중 BDNF(Brain-Derived Neurotrophic Factor)가 대표적이다.
2-3. 억제성 시냅스 단백질에 의한 신경회로 활성 조절
기능적인 억제성 신경회로가 만들어지는 과정은 복잡하며 수많은 내인적, 외인적 인자들에 의해서 시냅스에서의 억제성이 매개된다. 이러한 인자들은 다양한 형태의 억제성 신경세포들이 다른 신경세포의 수상돌기(Dendrite) 혹은 세포체에 시냅스를 형성할 때 서로 다르게 작동한다 (3). 일부 억제성 시냅스 단백질은 신경회로 발달에 중요한데 이들 단백질들의 기능이 망가질 경우 Fragile X-Syndrome이나 자폐와 같은 뇌발달질환이 발병할 수 있다. 본 총설에서는 NL-2와 NPAS4의 경우를 예시로 설명하고자 한다. NL-2 KO 마우스의 경우 흥미롭게도 Parvalbumin-Positive 억제성 신경세포으로부터 전달되는 신경전달 효율만 선택적으로 감소하는데 (그림 2), 이에 대한 정확한 분자기전은 잘 알려져 있지 않다. 한 가지 가능성은 NL-2와 결합하는 다양한 전시냅스 리간드 및 신경세포 내 결합 단백질들이 서로 다른 신경세포에서 발현하여 특정 억제성 시냅스 연결구조를 매개하는 것이다 (6). 전체적으로, NL-2는 억제성 시냅스 강도를 조절하여 신경활성에 의존적인 신경회로의 Refinement에 기여한다. NPAS4도 억제성 시냅스의 구조 및 기능을 조절한다 (13). 이를 뒷받침하듯 NPAS4 낙아웃 생쥐에서 억제성 시냅스 신경전달이 감소한다 (13, 14). 흥미롭게도 이러한 실험결과는 정상적인 Housing Condition에서 키운 NPAS4 낙아웃 생쥐에서는 관찰되지 않고, 오직 Enriched Environment 환경에서 키운 NPAS4 낙아웃 생쥐에서만 선택적으로 관찰되었다. 또한 NPAS4와 Target 단백질 중 하나인 BDNF가 신경세포의 세포체에 형성되는 억제성 시냅스 신경전달을 특이적으로 조절하는데, 이는 NPAS4에 의해 매개되는 신호전달 기전이 인지기능 등에 관여하는 신경회로의 억제 모드를 Reconfiguration할 수 있음을 시사하는 것이다. 또한 NPAS4는 신경세포 활성과 조합하여 서로 다른 신경세포에서 완전히 다른 Target 유전자들의 전사조절을 매개하여 고유한 신경회로의 항상성 기전에 관여한다 (그림 2).
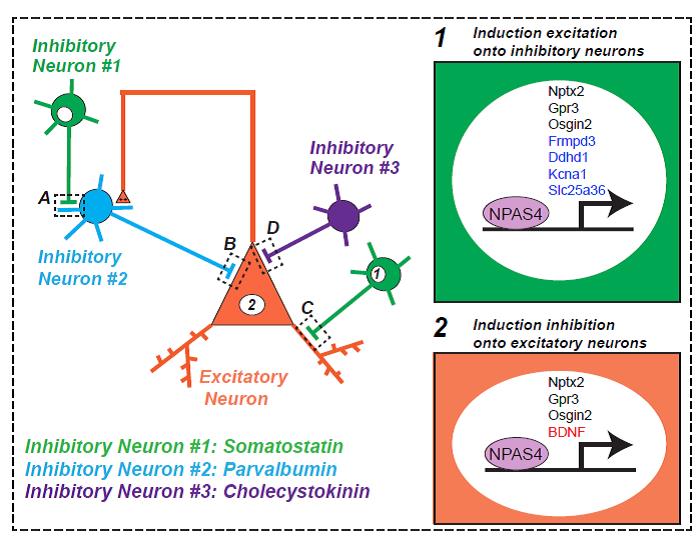
그림 2. 억제성 시냅스 단백질에 의한 신경회로 조절 기전
Pyramidal Neuron(주황색)과 연결된 서로 다른 Inhibitory Interneuron (녹색, 파란색, 혹은 보라색)들의 연결구조가 모식화되어 있으며, Pyramidal Neuron은 다른 신경세포들로부터도 Excitatory Input을 받게 된다. NL-2의 경우 Parvalbum-Positive Interneuron(B Synapse)를 수반한 억제성 신경회로 활성을 매개하며, Npas4는 Pyramidal Neuron(Nucleus Labeled 2)과 Inhibitory Neuron(Nucleus Labeled 1)에서 서로 다른 Target 유전자들을 활성화시킨다. Abbreviations: BDNF, Brain-Derived Neurotrophic Factor; Ddhd1, DDHD domain containing 1; Frmpd3, FERM and PDZ domain-containing 3; Gpr3, G-protein coupled receptor 3; Kcna1, potassium voltage-gated channel, shaker-related subfamily, member 1; Nptx2, neuronal pentraxin 2; Osgin2, Oxidative stress-induced growth inhibitor family member 2; and Slc25a36, Solute carrier family 25, member 36 (modified from Ko et al. Trends in Molecular Medicine 2015).
2-4. 억제성 시냅스의 기능 이상에 의한 뇌질환 발병
가바 시스템에 문제가 생길 경우 심각한 뇌질환이 생길 수 있음은 잘 알려져 있었기 때문에, 가바 수용체의 다양한 Agonist, Antagonist, 그리고 Allosteric Modulator 등이 다양한 뇌질환들의 치료약물로서 오래전부터 사용되어 왔다 (15). 특히 GABA-Metabolizing Enzyme(예를 들면 GABA Transaminase)이나 신경전달물질 Transporter(GAT1이나 Glycine Transporter 등)들을 타겟으로 한 약물들이 가바 시스템과 연관된 다양한 뇌질환을 앓고 있는 환자들에게 사용되어 왔다 (16). 이러한 약물들은 대개 가바 신경전달물질이 전시냅스 말단으로 Uptake되는 것을 감소시킨다. 반면, Benzodiazepine이나 Barbiturate는 가바 수용체에 의해 매개되는 Chloride Currents를 조절하여 억제성 시냅스 신경전달을 항진시킨다 (17). 하지만 이러한 약물들은 이후 의도치 않은 다양한 Side Effects가 있음이 알려지게 되어 현재는 제한적으로 사용되고 있다.
아직까지 구체적으로 개발되진 않았지만 상기 언급한 Neuroligin-2, Slitrk3, Gephyrin, Collybistin 및 NPAS4와 같은 억제성 시냅스 조절자 단백질들을 타겟으로 한 약물들도 미래에는 간질(Epilepsy)과 같은 뇌질환 약물로서 유망할 것으로 예측된다. 이들 단백질은 가바 수용체의 기능을 간접적으로 조절하고 다양한 억제성 시냅스의 형성, 신경전달 및 가소성 등을 정교하게 조절하는 단백질들로 현재 잘 알려져 있으나, 정확한 분자기전 등이 아직은 모호하므로 이들 단백질들의 기능 이해를 위한 기초의학 연구가 절실한 상황이다.
3. 결론
지금까지 억제성 시냅스의 구조와 기능을 조절하는 핵심인자들인 억제성 시냅스 조절자에 의한 시냅스 형성 및 신경회로의 조절, 그리고 이들 인자들의 기능이 망가졌을 경우 생길 수 있는 다양한 뇌질환들에 대해서 살펴보았다. 이들 단백질들은 뇌의 다양한 부위에 존재하는 다양한 시냅스에서 브레이크 역할을 하는데 이러한 작동기전에 문제가 발생할 경우 뇌 흥분성/억제성 균형이 망가져 신경회로 활성이 제대로 제어되지 않으며, 궁극적으로 다양한 뇌정신질환, 뇌발달질환 및 퇴행성 뇌질환 등이 발병하는 것이다. 따라서 흥분성 시냅스 단백질들 뿐만 아니라 본 총설에서 주로 논의한 억제성 시냅스 단백질들을 체계적으로 동정하고, 이들의 시냅스 기능을 이해하는 것은 시냅스 발달기전을 총체적으로 이해함과 동시에 뇌질환의 새로운 치료제 개발에 있어 효과적인 단서를 제공할 것이다. 앞으로 신경생물학자들은 더 깊이 있는 연구를 수행하여 근본적인 뇌질환 치료제들이 개발될 수 있도록 노력해야 할 것이다.
참고문헌
1. Sheng, M., Kim, E. (2011) The postsynaptic organization of synapses. Cold Spring Harb Prspect Biol. 1, pii. a005678.
2. Harris, KM., Weinberg, RJ. (2012) Ultrastructure of synapses in the mammalian brain. Cold Spring Harb Pespect Biol. 4, pii. a005587
3. Ko, J., Choii, G., Um, JW. (2015) The balancing act of GABAergic synapse organizers. Trends in Molecular Medicine 21, 256-268.
4. Brose, N., O’Connor, V., Skehel, P. (2010) Synaptopathy: dysfunction of synaptic function? Biochem Soc Trans 38, 443-444.
5. Choii, G., Ko, J. (2015) Gephyrin: a central GABAergic synaptic organizer. Experimental and Molecular Medicine 47, e158.
6. Gibson, JR., Huber, KM., Sudhof, TC. (2009) Neuroligin-2 deletion selectively decreases inhibitory synaptic transmission originating from fast-spiking but not from somatostatin-positive interneurons. Journal of Neuroscience.;29, 13883-13897.
7. Takahashi, H., Katayama, K., Sohya, K., et al. (2012) Selective control of inhibitory synapse development by Slitrk3-PTPδ trans-synaptic interaction. Nature Neuroscience 15, 389-398.
8. Yim, YS., Kwon, Y., Nam, J., et al. (2013) Slitrks control excitatory and inhibitory synapse formation with LAR receptor protein tyrosine phosphatases. Proc Natl Acad Sci U S A 110, 4057-4062.
9. Um, JW., Ko, J. (2013) LAR-RPTPs: synaptic adhesion molecules that shape synapse development. Trends in Cell Biology 23, 465-475.
10. Mattheisen, M., Samuels, JF., Wang, Y. et al. (2015) Genome-wide association study in obsessive-compulsive disorder: results from the OCGAS. Molecular Psychiatry 20, 337-344.
11. Papadopoulos, T., Soykan, T. (2011) The role of collybistin in gephyrin clustering at inhibitory synapses: facts and open questions. Frontiers in Cellular Neuroscience 5, 11.
12. Lin, Y., Bloodgood, BL., Hauser, JL. et al. (2008) Activity-dependent regulation of inhibitory synapse development by Npas4. Nature 455, 1198-1204.
13. Bloodgood, BL., Sharma, N., Browne, HA. et al. (2013) The activity-dependent transcription factor NPAS4 regulates domain-specific inhibition. Nature 503, 121-125.
14. Spiegel, I., Mardinly, AR., Gabel, HW. et al. (2014) Npas4 regulates excitatory-inhibitory balance within neural circuits through cell-type-specific gene programs. Cell 157, 1216-1229.
15. Ramamoorthi, K., Lin, Y. (2011) The contribution of GABAergic dysfunction to neurodevelopmental disorders. Trends in Molecular Medicine 17, 452-462.
16. Schousboe, A., Madsen, KK., Barker-Haliski, ML. et al. (2014) The GABA synapse as a target for antiepileptic drugs: a historical overview focused on GABA transporters. Neurochem Res 39, 1980-1987.
17. Bialer, M., White, HS. (2010) Key factors in the discovery and development of new antiepileptic drugs. Nat Rev Drug Discov. 9, 68-82.
첨부파일