
생화학분자생물학회입니다.
PI3K-AKT-mTOR 신호전달경로와 연관된 신경발달질환 연구동향
작성자
관리자작성일자
2018-01-01조회수
1443PI3K-AKT-mTOR 신호전달경로와 연관된 신경발달질환 연구동향

백승태
POSTECH 융합생명공학부
sbaek@postech.edu
1. 서론
세포의 분화, 증식과 성장, 사멸 및 대사 등을 조절할 뿐 아니라 암 발생에도
밀접하게 연관된 PI3K (Phosphatidylinositol-3-Kinase)-AKT (Protein Kinase
B)-mTOR (mammalian Target of Rapamycin) 신호전달경로는 뇌 발달과정부터 태어난 이후 신경세포의 기능에
이르기까지 여러 단계에서 필수적인 역할을 한다. 따라서 이 신호전달경로의 이상은 곧 여러 신경발달질환의
원인이 되며, 대표적으로는 대뇌피질기형(Malformation of Cortical
Development)에 속하는 결절성 경화증(Tuberous Sclerosis Complex), 국소피질이형성증 (Focal Cortical Dysplasia), 반구거대증(Hemimegalencephaly),
MPPH(Megalencephaly-Polymicrogyria-Polydactyly-Hydrocephalus) Syndrome 등이
있다. 최근 연구결과는 이전까지는 다른 질병으로 여겨졌던 이들 신경발달질환이 상당수 환자에서 유전적으로는
같은 신호전달경로, 즉 PI3K-AKT-mTOR Pathway의
비정상적인 활성화로 설명될 수 있음을 시사하고 있다. 이들 질병들은 물론 각기 특징적인 증상이 있는
반면 뇌전증(Epilepsy)과 이로 인한 지체장애, 음성
종양 혹은 비대증 등 상대적으로 공통적으로 종종 발견되는 임상 증상도 다수 있다. 특히 세포 수준에서는
PI3K-AKT-mTOR Pathway의 과다한 활성화로 인한 세포 비대증 등의 병리 증상을 공통적으로
볼 수 있다. 치료적인 관점에서 이들 질환은 외과적인 방법이 주가 되었으나 최근 연구결과는 공통된 유전학적
원인을 근거로 하여 약물을 사용한 치료 가능성이 대두되고 있다. 즉,
PI3K-AKT-mTOR에서 하위에 있는 mTOR 억제제를 사용하여 병증을 억제하거나 증상을
완화하는 전략이다. 이러한 치료법은 일찍이 그 유전적 원인이 알려져 있는 결절성 경화증 환자에서 사용되었다. 본 보고에서는 PI3K-AKT-mTOR 신호전달경로의 과다활성화가
그 원인으로 지목되고 있는 신경발달질환 중 특징적으로 뇌의 일부 세포에서만 유전 결함이 발견된 국소피질이형성증과 반구거대증의 발달병리기전에 관한
최근 연구 동향과 함께 이들 기초연구로부터 얻은 연구결과가 다른 신경발달질환의 병리기전 이해에 어떻게 확장되고 있는지 간단히 소개하고자 한다.
2. 본론
2-1. 국소피질이형성증과
반구거대증의 유전 요인
대뇌피질 발달기형은 발달과정 중 정상적인
대뇌 형성에 관여하는 세포들의 이상으로 유발되는 광범위한 피질병변을 말한다 (1). 국소대뇌피질기형은 이러한 피질병변이 특징적으로 대뇌의 일부분에만 관찰되며
이러한 질병에는 반구거대증과 국소피질이형성증을 들 수 있다. 반구거대증은 뇌의 한 쪽 반구가 비대해지는
특징적인 증상을 보이며 피질이형성성증과 함께 발달장애 및 지체장애 등을 유발하며 소아에서 약물저항성을 보이는 뇌전증의 대표적인 원인질환 중 하나이다
(2). 이들
질환에서 뇌전증 치료를 위해서는 외과적인 절제술을 고려해 볼 수 있으나 시기와 병증을 보이는 뇌 부위에 따라서 그 적용이 매우 제한적이며, 약 20% 이상의 환자에서 수술 후에도 뇌전증 개선을 보이지 않음이
보고되었다. 질병의 원인은 한동안 알려지지 않았으나 최근 분자생물학 및 유전학적 연구를 통해 많게는 50%의 환자에서 PI3K-AKT-mTOR 신호전달경로 상에 있는
유전자의 돌연변이가 주요 원인으로 밝혀지고 있다 (3) (그림 1).
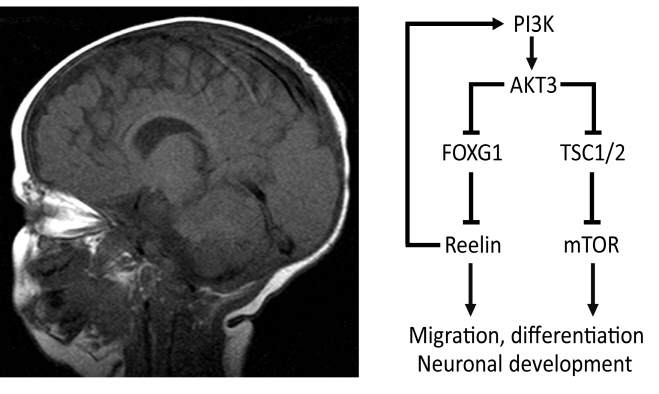
그림 1. 신경발달질환과 PI3K-AKT-mTOR 신호전달경로
PI3K-AKT-mTOR 신호전달경로에 관여하는 여러 유전자들의 돌연변이가 신경발달질환에서 발견되었다. 관련 신호전달경로의 비정상적인 활성화를 유발하는 이들 돌연변이로 인해 배아 시기 정상적인 뇌 발달에 이상이
초래된다.
환자 뇌조직에 대한 유전자 분석 결과에서 흥미롭게도 돌연변이는 병증을 보이는 뇌 조직에 특이적으로 존재하며 8%에서 50%의 다양한 비율로 발견되었다. 따라서 마치 암처럼 체세포 수준에서의 돌연변이가 반구거대증이나 국소피질이형성증과 같은 국소대뇌피질기형의 주요
원인이 될 수 있음을 시사한다 (4). 환자에게서 발견된 돌연변이를 살펴보면 PI3K-AKT-mTOR 신호전달기전에
관여하는 여러 유전자들 중에서 PIK3CA, PIK3R2, AKT3, TSC1, TSC2뿐 아니라 MTOR 유전자에서 아미노산의 변화를 유발하는 점 돌연변이 (Point Mutation)가
발견되었다 (5-7). 흥미롭게도
국소피질이형성증 환자에게서 돌연변이가 발견된 TSC1, TSC2는 결절성 경화증의 주된 원인 유전자이다. 이들
돌연변이 중 상당수는 하위 신호전달경로의 활성을 증가시키는 것으로 기존에 보고된 바 있다. 세포의 성장과
사멸에 관여하는 유전자의 이상이 암 발생에 선택적인 요소로 작용할 수 있음은 잘 알려져 있다. 따라서
암 발생처럼 이들 유전자에서 일어나는 돌연변이가 발달과정 동안 성장에 이익을 주는 등의 선택적 요소를 제공할 가능성과 같은 병리기전 상의 공통점을
생각해 볼 수 있다. 이들 환자에게서 발견된 PIK3CA, PIK3R2, AKT3, MTOR, TSC1, TSC2 유전자 상의 상당수 돌연변이가 여러 암세포에서도 종종 발견된다는 점은 이런 가설을
뒷받침한다.
각각의 유전자를 간략하게 살펴보면 PI3K를 구성하는 단백질
서브유닛인 PIK3CA와 PIK3R2는 외부 자극이나 호르몬
등에 의한 활성화된 수용체의 신호를 하위 신호전달계로 전달하며 그중 하나는 바로 AKT3이다. AKT3는 뇌에서 주로 발현되는 Protein Kinase B로도
불리며 TSC1/2와 mTOR의 상위에서 역할을 한다. 앞서 언급했듯이 환자에게서 발견된 돌연변이는 각각의 단백질을 비정상적으로 활성화시킨다고 알려져 있다. 분자 수준에서는 돌연변이의 결과로 PI3K-AKT-mTOR 신호전달경로가
비정상적으로 활성화되며 리보솜 및 단백질 합성 증가 등이 대표적인 효과이다. 이는 mTOR가 일반적으로 세포의 동화작용(Anabolic Pathway)에
밀접하게 관련이 되어 있기 때문이다. 리보솜 단백질 중 하나인 S6 의
인산화(Phosphorylation) 증가는 대표적인 mTOR 활성화의
한 지표로 사용되며, 흥미롭게도 여러 신경 발달장애 환자의 뇌 조직에서 종종 관찰된다. 아직 일반화해서 단정 짓긴 어렵지만 PI3K-AKT-mTOR 신호전달경로의
이상이 여러 신경 질환에 직간접적으로 광범위하게 연관되어 있을 가능성을 내포한다.
2-2. 질병 모델과 치료 전략
환자에게서 발견된 돌연변이들을 발달과정 중에 있는 생쥐 배아의 일부 신경세포에 도입한 질병 모델 연구를
통해 발달병리기전이 규명되었다 (8). 이를 살펴보면 환자에서 MRI (Magnetic Resonance Imaging)를
통해 관찰되는 국소대뇌피질기형의 대표적인 증상 중 하나인 대뇌 피질의 구조적인 결함이 발달과정 중 일어나는 정상적인 신경세포의 이동(Neuronal Migration)에 결함으로 인해 발생 됨이 밝혀졌다. 세포
수준에서는 형태학적인 결함인 세포 비대증(Cytomegaly)과 이형신경세포(Dysmorphic Neuron)도 관찰되며 개체 수준에서는 뇌전증이 유발됨을 보여주고 있다. 환자에 따라서는 병변을 보이는 뇌 조직의 DNA 중에서 돌연변이가 2% 미만의 적은 비율로 발견되는 경우도 있다. 그에 반해 대뇌 구조기형은
상대적으로 더 넓은 범위에서 관찰된다. 또한 경우에 따라서는 비정상적인 모양을 띠고 있는 신경세포들
중에서 돌연변이가 발견되지 않는 경우도 있다. 이는 돌연변이를 가지고 있는 세포들이 인접한 정상 세포까지
영향을 미쳐서 유발되며, 한 가지 기전으로 PI3K-AKT 신호전달경로
하위에 있는 Reelin의 비정상적인 조절이 제시되고 있다. Reelin은
뇌의 발달과정 중에 대뇌피질 바깥쪽에 위치한 Cajal-Retzius 세포에 의해서 생성되어 세포 밖으로
분비된다. 그러나 돌연변이에 의해 PI3K-AKT 신호전달경로가
과도하게 활성화되면 Reelin의 전사 억제에 관여하는 FOXG1의
불활성화가 촉진되어 Reelin의 합성이 억제되어 있는 신경세포에서 비정상적인 Reelin의 합성의 유발되고 이로 인해 인접한 정상적인 신경세포의 발달과정에 영향을 미치며, 상대적으로 광범위한 대뇌 구조기형이 유발한다고 보고되었다. 특징적으로
대뇌 구조기형의 유발 기전은 배아 시기에 특이적인 병리기전이며 발달 단계가 끝난 이후에는 돌연변이의 효과를 억제해도 되돌릴 수 없는 증상 중 하나이다. 물론 배아시기에 돌연변이 효과를 조절함으로써 구조기형 형성을 억제할 수 있다.
동물 모델을 사용한 기전연구를 통해 제시된 치료 전략 중 하나는 PI3K-AKT-mTOR 신호전달경로에서
하위에 있는 mTOR 억제제(Rapamycin)를 사용하는
것이다. 이러한 전략을 적용한 동물모델에서 비단 발달과정 중에 유발되는 세포 및 대뇌기형의 형성이 억제될
뿐만 아니라 뇌전증도 효과적으로 완화할 수 있음이 보고되었다. mTOR 억제제는 대뇌피질기형의 일종인
결절성 경화증 환자에서 종종 관찰되는 증식성 음성 종양인 하엽 결절(Subependymal Nodule, SEN)과
하엽 거대세포 성상 세포종(Subependymal Giant Cell Astrocytoma, SEGA)의
치료에 사용된다.
다소 낙관적인 전망일 수는 있으나 PI3K-AKT-mTOR 신호전달경로의
이상이 여러 신경질환에 직간접적으로 광범위하게 연관되어 있다면 관련된 신호전달경로를 약물을 이용하여 조절함으로써 질병 치료에 이를 가능성이 조심스럽게
대두되고 있다. PI3K-AKT-mTOR 신호전달경로는 비단 mTOR
억제제뿐 아니라 여러 암 연구를 통해 기존에 개발된 PI3K 혹은 AKT 억제제들이 다수 있다. 한 가지 예로 PIK3CA 유전자의 돌연변이로 인해 유발되는 MPPH(Megalencephaly-Polymicrogyria-Polydactyly-Hydrocephalus)
Syndrome의 경우에 PI3K Inhibitor를 사용한 치료 전략이 동물 모델을 통해
제시된 바 있다 (9).
2-3. 남은 가설과 궁금증
국소피질이형성증과 반구거대증 연구는 여러 가지 의문점을 해소하고 이전에는 없던 효과적이며 새로운 치료 전략에
대한 희망을 제시해 준 반면 배아 발생 과정 중에 어떤 이유로 체세포 돌연변이가 일어났는지에 대한 정확한 기전은 아직 밝혀져 있지 않다. 몇 가지 제시되는 설명 중 하나는 레트로트렌스포존(Retrotransposon)에
의한 체세포 돌연변이 유발이다 (10). Genome의 30% 넘게 차지하는 레트로트렌스포존은 전사 과정을
통해 Genome 상의 다른 곳에 와 복제될 수 있으며, 이
과정 동안 여러 가지 변이가 유발될 수 있다. 사람의 Genome에
있는 대부분의 레트로트렌스포존은 필수적인 요소가 결여된 형태로 존재하지만 100여 개 내외는 레트로이동(Retrotransposition)이 가능하며, 이 가운데 대략 10% 내외는 레트로이동이 종종 관찰되는 것으로 알려져 있다.
신경세포들의 염기서열을 분석한 최근 연구결과는 신경세포들이 면역세포를 제외한 다른 체세포에 비해 높은 비율로
유전자의 변이를 가지고 있음이 밝혀졌다. 대부분의 신경세포는 배아 시기에 생성된다는 사실을 고려할 때
외부적인 요인, 즉 조절되지 않는 환경적인 요인만으로는 설명하기 어렵다. 또한 각각의 변이가 한 개의 신경세포에서만 존재할 뿐 서로 중복되지 않는다는 사실로부터 유전자 변화가 배아
시기에 생성되어 이후 세포분열을 통해 동일한 변이를 가지고 있는 세포들이 다수 생성된 것이 아니라 분화가 끝난 후에 개별 세포 수준에서 광범위하게
일어났을 가능성을 제시한다. 이러한 돌연변이 중 성장과 분열에 영향을 미치는 돌연변이를 가진 세포가
선택적인 이점(Selective Advantage)을 가짐으로써 발생 과정 동안 확장되어 질병을 유발할
가능성도 고려되고 있다. 이는 암 발생과 상당히 유사한 기전으로써 국소피질이형성증 등을 유발하는 돌연변이가
여러 가지 암에서도 발견된다는 점에서 설득력이 있으나 이들 환자에게서 왜 암 발병률의 뚜렷한 증가가 관찰되지 않는지는 설명하기 어렵다. 돌연변이 생성의 다른 가능성 중 하나는 유전자 발현에 의한 것이다. 최근
연구를 통해 Genome 상에서 유전자 발현에 필요한 전사인자와 상호작용이 빈번한 DNA 부위가 상대적으로 그렇지 않은 곳에 비해서 DNA Repair와
연관된 돌연변이가 더 빈번하게 발견됨이 보고되었다 (11). 이와 관련된 중요한 발견 중 하나는 신경세포에 특이적인 일부 유전자의 발현에 전사인자뿐만 아니라 DNA Topoisomerase에 의한 Double Strand Break가
중요한 요소로 작용한다는 점이다 (12). 신경세포의 기능에 관여하는 일부 유전자들은 외부 자극에 빠르게 반응하여 전사가 일어나는 유전자(Immediate Early Gene, IEG)로서 이들 유전자의 빈번한 발현은 지속적인 Double Strand Break 생성과 연관되며, DNA Repair가
제대로 이루어지지 않을 경우 돌연변이를 유발할 수 있다. 한 가지 흥미로운 점은 몇몇 IEG는 신경세포에서 돌연변이 생성 기전의 하나로 제시되고 있는 레트로트렌스포존과 관련이 있는 레트로바이러스 Oncogene의 Homologue들이다. 이러한 기전에 의해 신경발달질환과 연관된 돌연변이들이 발생할 수 있는지에 대한 후속 연구가 필요하다.
3. 결론
위에서 살펴본 신경발달질환은 그동안 외과적 접근 이외에는 효과적인 비 침습적 치료방법이 없었던 질환에서
원인 규명과 함께 질병 모델을 활용한 발달병리기전에 대한 연구가 어떻게 효과적인 치료 전략을 제시하고, 실제
임상으로 이어져 환자에게 도움이 될 수 있는지를 잘 보여주고 있다. 최근 염기서열 분석 기술의 비약적인
발전으로 많은 신경발달질환에 대한 유전 요인이 밝혀지고 이에 근거한 정확한 진단 또한 가능해졌다. 이를
바탕으로 보다 많은 신경발달질환의 효율적인 치료가 가능해지기를 기대한다.
4. 참고문헌
1. Aronica, E., Becker, A. J., Spreafico, R. (2012) Malformations of
cortical development. Brain Pathol
22, 380-401.
2. Baek, S. T., Gibbs, E. M., Gleeson, J. G., Mathern, G. W. (2013)
Hemimegalencephaly, a paradigm for somatic postzygotic neurodevelopmental
disorders. Curr Opin Neurol 26,
122-127.
3. Jansen, L. A., Mirzaa, G. M., Ishak, G. E., et al. (2015)
PI3K/AKT pathway mutations cause a spectrum of brain malformations from megalencephaly
to focal cortical dysplasia. Brain
138, 1613-1628.
4. Poduri, A., Evrony, G. D., Cai, X., Walsh, C. A. (2013) Somatic
mutation, genomic variation, and neurological disease. Science 341, 1237758.
5. Lee, J. H., Huynh, M., Silhavy, J. L., et al. (2012) De novo
somatic mutations in components of the PI3K-AKT3-mTOR pathway cause
hemimegalencephaly. Nat Genet 44,
941-945.
6. Lim, J. S., Gopalappa, R., Kim, S. H., et al. (2017) Somatic
Mutations in TSC1 and TSC2 Cause Focal Cortical Dysplasia. Am J Hum Genet 100, 454-472.
7. Lim, J. S., Kim, W. I., Kang, H. C., et al. (2015) Brain somatic
mutations in MTOR cause focal cortical dysplasia type II leading to intractable
epilepsy. Nat Med 21, 395-400.
8. Baek, S. T., Copeland, B., Yun, E. J., et al. (2015) An
AKT3-FOXG1-reelin network underlies defective migration in human focal
malformations of cortical development. Nat
Med 21, 1445-1454.
9. Roy, A., Skibo, J., Kalume, F., et al. (2015) Mouse models of
human PIK3CA-related brain overgrowth have acutely treatable epilepsy. Elife 4, 12703.
10. Muotri, A. R., Chu, V. T., Marchetto, M. C., Deng, W., Moran, J. V.,
Gage, F. H. (2005) Somatic mosaicism in neuronal precursor cells mediated by L1
retrotransposition. Nature 435,
903-910.
11. Sabarinathan, R., Mularoni, L., Deu-Pons, J., Gonzalez-Perez, A.,
Lopez-Bigas, N. (2016) Nucleotide excision repair is impaired by binding of
transcription factors to DNA. Nature
532, 264-267.
12. Madabhushi, R., Gao, F., Pfenning, A. R., et al. (2015)
Activity-Induced DNA Breaks Govern the Expression of Neuronal Early-Response
Genes. Cell 161, 1592-1605.
첨부파일