
생화학분자생물학회입니다.
Integrated Lab of Metabolism, Obesity and Diabetes Research (iMOD)
작성자
관리자작성일자
2016-07-01조회수
563Integrated Lab of Metabolism, Obesity and Diabetes Research (iMOD)
서재명
한국과학기술원 의과학대학원 통합 대사, 비만, 당뇨 연구실

[연구실 개관]
서재명 교수 연구실은 한국과학기술원 의과학대학원에서 비만이나 당뇨병과 같은 대사 질병에 대한 의과학 연구를 집중적으로 수행하고 있는 서재명, 김하일, 이윤석 교수의 통합 대사, 비만, 당뇨 연구실의 일부를 이루고 있음.
* 본 연구실은 지방조직 분화와 발생 및 비만, 근감소증 등에서의 핵내 수용체 (Endonuclear Receptor)의 역할에 연구의 초점을 두고 있음.
* 대사 질병이라는 공통된 분야를 연구 주제로 두고 있는 세 교수의 실험실이 선진화된 open lab 형태로 공간과 기자재를 공유하면서 아이디어 및 실험 노하우, 인력과 기자재의 공유 등 다양한 시너지 효과를 꾀하고 있음.
* 또한 한국과학기술원 의과학대학원의 의사과학자(MD-PHD) 병역특례 제도를 이용하여 랩 내에 내과 및 성형외과 전문의 등 다양한 전공의 전문의를 학생으로 보유하고 있어 최근 더욱 중요시되고 있는 기초 연구 결과의 임상적 접점을 찾는 중개 연구에 특장점을 보유하고 있음. (의과학 대학원 홍보 영상자료 : https://www.youtube.com/watch?v=UYsx6MNT9pM)
[연구 주제]
1. 대사 질환에서 핵내 수용체 PPARγ - FGF1 축의 역할 규명과 이를 이용한 지방 세포 리모델링 치료제 개발
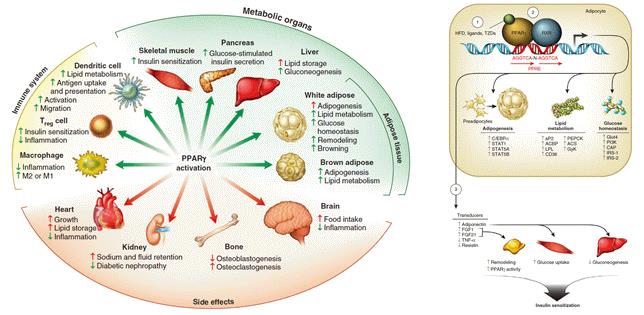
그림 1. 지방조직의 다양한 생명 현상을 총괄하는 핵수용체 PPARγ
본 연구실은 대사 항상성 유지에 중요한 지방조직리모델링에서 PPARγ-FGF1 axis의 역할을 밝히고, 그에 따른 FGF1의 혈당강하 효과 및 인슐린 감작작용의 기전을 밝혀, 비만, 대사증후군 및 당뇨와 같은 대사질환의 병인규명과 치료제 개발을 위한 신규 기반 지식을 제공하고자 함.
* 지방조직(Adipose Tissue)은 에너지 과잉상태에서는 늘어나 에너지를 저장하고, 에너지 부족상태에서는 줄어들며 에너지를 생산해내는 동적 조절(Dynamic Regulation) 상태를 유지하고 있는데, 이러한 지방조직의 가소성(Plasticity)이 대사 항상성 유지에 큰 역할을 함. 이러한 현상의 중심에는 핵수용체인 PPARγ(Peroxisome Proliferator-Activated Receptor Gamma)가 있어, 지방세포생성(Adipogenesis)과 지방세포(Adipocyte)의 기능 유지에 Master Regulator로 작용하며 지방조직의 생명 현상을 관장하고 있음. 지방조직에서 PPARγ는 수백 개의 하부 조절 유전자(Downstream Target Genes)를 조절하여 지방세포분화, 지질 흡수와 저장, 아디포카인(Adipokine) 생산 등 다양한 지방조직의 현상을 조율하고 있음.
* FGF(Fibroblast Growth Factor)는 150개에서 300개의 아미노산으로 이루어진 단백질로, 이 중 FGF21은 주로 간과 지방조직에서 발현하여 탄수화물과 지질의 대사를 조절함. 특히, FGF21은 고지방식이와 PPARγ Agonist에 의하여 백색지방에서 높은 수준으로 유도되는데, 에너지 섭취 시에 PPARγ는 FGF21을 유도하고 이는 지방조직에 국소적으로 작용하여 PPARγ 활성을 증폭시키고 인슐린 감작을 증가시키는 것으로 밝혀짐. FGF21과 관련한 연구는 상당히 진척되었으나 FGF21은 지방조직에서의 혈당강화 효과를 일으키는 것 외에도 중추신경계에 작용하여 성장을 저하시키고, 혈중 호르몬 레벨에도 영향을 주어 골감소증도 초래하는 부작용이 있음.
* FGF1은 가장 최근에 밝혀진 PPARγ 의 직접적인 전사 타겟(Transcriptional target)으로, 지방조직리모델링(Adipose Tissue Remodeling)에서 핵심적 역할을 하는 것으로 생각됨. 또한 외부에서 투여 시 단 한번으로도 상당히 장시간의 혈당 강하 효과가 저혈당 없이 나타나고, 지속적으로 투여할 시 인슐린 감작작용이 나타나는 것으로 관찰됨. 때문에, FGF1의 지방조직리모델링 기전과 혈당 강화 효과 및 인슐린 감작작용의 기전을 밝힌다면 강력한 대사 질환 치료제 개발을 위한 토대가 될 것으로 생각됨.
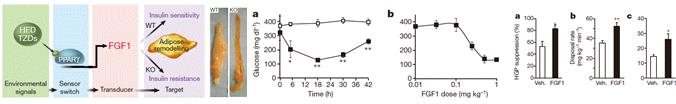
그림 2. PPARγ 의 하위 물질로서 FGF1 의 지방조직리모델링과 혈당 강하 효과 및 인슐린 감작작용
2. 노쇠(Frailty) 및 근감소증(Sarcopenia)에서 핵 내 수용체 – FGF 축의 역할
본 연구실은 급격한 고령화로 인하여 어느 때보다 사회적 의미가 중요해지고 있음에도 불구하고 현재까지 치료 가능한 기전이 충분히 밝혀지지 않은 노쇠(Frailty) 및 근감소증(Sarcopenia)에서 핵 내 수용체 – FGF 축의 역할을 규명하여, 기존에 존재하지 않던 새로운 치료 경로를 제시하고자 함.
* 최근 운동에 의한 근력 향상과 근육량 증대에 근육 손상과 이에 따른 근육줄기세포(Satellite Cell)의 활성화와 이와 연관된 근 섬유 조직의 리모델링 등이 필수적임이 알려짐.
* 이와 같은 근 섬유 리모델링, 특히 근육줄기세포의 증식과 분화에 FGF Family의 역할이 중요함이 알려져 있음. 이에, 기존에 개발중인 근감소증에 대한 치료 약제가 대부분 Myostatin Pathway 등을 조절하여 근육 섬유의 단백 합성/분해에 대한 미세한 균형을 개선하는 것에 초점을 맞추어 임상적 효과가 뚜렷하지 않은 것에 반하여, 본 연구진은 근육 조직의 손상 후 리모델링 과정에 대한 연구를 통하여 기존에 존재하지 않는 새로운 근감소증과 노쇠에 대한 치료 가능 타겟을 개발하고 있음.
[연구책임자]

서재명 교수
주소 : 대전광역시 유성구 대학로 291 한국과학기술원 (34141)
전화번호 : 042-350-4247 (방), 042-350-4283 (연구실)
E-mail : jmsuh@kaist.ac.kr
[연구진구성]
교수 : 서재명
박사과정 : 정희원, 조태희
석박통합과정 : 신혜미
연구원/행정원 (iMOD 통합) : 김주은, 선우정혜, 엄혜영, 정희생, 최명숙
<서재명 교수님과 학생들 (왼쪽부터 정희원, 신혜미, 서재명, 조태희)>


[대표논문]
1. Bapat, S.P., Suh, J.M., Fang, S., Liu, S., Zhang, Y., Cheng, A., Zhou, C., Liang, Y., LeBlanc, M., Liddle, C., Atkins, A.R., Yu,
R.T., Downes, M., Evans, R.M., and Zheng, Y. (2015) Depletion of Fat Tregs Prevents Age-Associated Insulin Resistance.
Nature, 528, 137-141.
2. Wall, C.E., Whyte, J., Suh, J.M., Fan, W., Collins, B., Liddle, C., Yu, R., Atkins, A.R., Naviaux, J.C., Li, K., Bright., A.T.,
Alaynick, W.A., Downes, M., Naviaux, R.K, and Evans, R.M. (2015) High-fat diet and FGF21 cooperatively promote aerobic
thermogenesis in mtDNA mutator mice. Proc Natl Acad Sci USA, 112, 8714-9.
3. Fang, S., Suh, J.M., Reilly, S.M., Yu, E., Osborn, O., Lackey, D., Yoshihara, E., Perino, A., Jacinto, S., Lukasheva, Y.,
Atkins, A.R., Khvat, A., Schnabl, B., Yu, R.T., Brenner, D.A., Coulter, S., Liddle, C., Schoonjans, K., Olefsky, J.M.,
Saltiel, A.R., Downes, M., and Evans, R.M. (2015) Intestinal FXR agonism promotes adipose tissue browning and reduces
obesity and insulin resistance. Nat Med, 21, 159-65.
4. Suh, J.M., Jonker, J.W., Ahmadian, M.A., Goetz, R., Lackey, D., Huang, Z., Osborn, O., van Dijk, T., Yoshihara, E., Liu, W.,
Havinga, R., Fan, W., Yin, Y., Yu, R.T., Liddle, C., Atkins, A.R., Olefsky, J.M., Mohammadi, M., Downes, M., and Evans, R.M.
(2014) Endocrinization of FGF1 produces a neomorphic and potent insulin sensitizer. Nature, 513, 436-9.
5. Stenesen, D., Suh, J.M., Seo, J., Yu, K., Lee, K.S., Kim, J.S., Min, K.J., and Graff, J.M. (2013) Adenosine nucleotide
biosynthesis and AMPK regulate adult life span and mediate the longevity benefit of caloric restriction in flies. Cell Metab, 17,
101-12.
6. Jonker, J.W., Suh J.M., Atkins, A.R., Ahmadian, M., Li, P., Whyte, J., He, M.X., Juguilon, H., Yin, Y., Phillips, C.T., Yu, R.T.,
Olefsky, J.M., Henry, R.R., Downes, M., and Evans, R.M. (2012) A PPARγ-FGF1 axis is required for adaptive adipose
remodeling and metabolic homeostasis. Nature, 485, 391-394.
7. Zeve, D., Seo, J., Suh, J.M., Stenesen, D., Tang, W., Berglund, E.D., Wan, Y., Williams, L.J., Lim, A., Martinez, M.J.,
McKay, R.M., Millay, D.P., Olson, E.N., Graff, J.M. (2012) Wnt signaling controls an insulin-independent mechanism to
regulate glucose uptake. Cell Metab, 15, 492-504.
8. Tang, W., Zeve, D., Suh, J.M., Bosnakovski, D., Kyba, M., Hammer, B., Tallquist, M.D., Graff, J.M. (2008). White fat
progenitor cells reside in the adipose vasculature. Science, 322, 583-6.
9. Suh, J.M., Zeve, D., McKay, R., Seo, J., Salo, Z., Li, R., Wang, M., and Graff, J. M. (2007). Adipose is a conserved dosage-
sensitive anti-obesity gene. Cell Metab 6, 195-207.
10. Suh, J.M., Gao, X., McKay, J., McKay, R., Salo, Z. and Graff, J. M. (2006). Hedgehog signaling plays a conserved role in
inhibiting fat formation. Cell Metab, 3, 25-34.
11. Han, S.Y., Kim, J.C., Suh, J.M., and Chung, I.K. (2001). Cell type-dependent regulation of human DNA topoisomerase III
alpha gene expression by upstream stimulatory factor 2. FEBS Lett, 505, 57-62.
12. Ford, L.P., Suh, J.M., Wright, W.E., and Shay, J.W. (2000). Heterogeneous nuclear ribonucleoproteins C1 and C2 associate
with the RNA component of human telomerase. Mol Cell Biol, 20, 9084-9091.
13. Suh, J.M., Lee, G.E., Kim, Y.M., Lee, J.H., Kim, D.M., Suh, J.W., and Chung, I.K. (1996) Genomic structure of a double-
stranded RNA virus in the parasite Leishmania major. Mol. Cells 6, 40-44.
14. Lee, S. E., Suh, J. M., Scheffter, S., Patterson, J. L. and Chung, I. K. (1996). Identification of a ribosomal frameshift in
Leishmania RNA virus 1-4. J Biochem, 120, 22-5.