
생화학분자생물학회입니다.
GITR 자극 면역 항체의 새로운 항암 기전 규명
작성자
관리자작성일자
2016-08-01조회수
806GITR 자극 면역 항체의 새로운 항암 기전 규명
Glucocorticoid-induced tumor necrosis factor receptor–related protein co-stimulation facilitates tumor regression by inducing IL-9–producing helper T cells. Nat Med. 21(9):1010-7, 2015


김일규 강창율
서울대학교 약학대학 서울대학교 약학대학
royswit@gmail.com cykang@snu.ac.kr
연구배경
항암 면역 치료법이 최근 좋은 성과와 더불어 큰 관심을 받고 있다 (1, 2). 기존의 암 치료는 외과적 절제 수술과 화학 요법, 방사선 요법과 같이 특이성 없이 암에 직접적으로 작용하는 치료법들이 많이 사용되어 왔으며 이는 항상 부작용들이 동반되었다. 이에 반해 면역 치료법은 항체 치료 및 세포 치료제를 이용하는 방법으로 부작용이 적으면서 보다 효율적인 치료 효과를 보여주고 있다. 이중 최근 가장 인상적인 성과를 보여주고 있는 것은 항체를 이용한 면역 치료법이다. 항암 항체 치료제는 초기에는 암을 타겟으로 하는 표적 치료법으로 사용되기 시작하여 최근에는 암이 아닌 체내 면역 세포에 작용하여 항암 반응을 증진시키는 방법으로 사용되고 있다 (2). 가장 대표적인 예가 면역 관문(Checkpoint)인 CTLA-4와 PD-1을 저해하는 항체로 이 항체들은 이미 여러 종류의 암 환자에서 좋은 치료 효과를 보여주었으며, 이렇게 암에 대응하여 체내 면역 반응을 증진시킬 수 있는 타겟을 찾는 연구가 계속 진행 중에 있다 (3-5).
그 중 하나인 GITR(Glucocorticoid-Induced Tumor Necrosis Factor Receptor–Related Protein)은 공자극 분자 중 하나로 이를 타겟으로 하는 항체는 T 세포의 기능을 증진시켜 항암 효과를 낸다는 것이 여러 마우스 암 모델에서 알려졌으며 인간 GITR을 타겟으로 하는 항체 또한 임상 시험 중에 있다 (4). 하지만, 아직까지 그 항암 기전에 관해선 IFN-γ가 중요하다든지 조절 T 세포를 억제하여 효과를 나타낸다든지 부분적이거나 불분명한 부분이 많이 있는 상황이었다 (6).
CD4 T 세포는 적응 면역의 핵심 세포로 항암 반응에서도 그 중요성이 잘 알려져 있다. CD4 T 세포는 여러 아형이 있으며 공자극 분자 자극 시 여러 사이토카인 및 전사 인자를 유도하여 각 아형으로의 분화에 영향을 미친다 (7). 가장 최근에 발견된 CD4 T 세포 아형 중 하나인 Type 9 Helper T(Th9) 세포는 Interleukin(IL)-9을 주요하게 내는 세포로 흑색종 모델에서 여러 CD4 T 세포 아형 중 가장 강한 항암 반응을 내는 것으로 보고되었다 (8, 9). 이에 본 연구진은 GITR 자극 항체가 Th9 세포의 분화에 영향을 주는 것은 아닌지 여부에 관심을 가지고 연구를 시작하게 되었다.
연구결과
1. IL-9 의존적인 GITR 자극 항체의 항암 작용
GITR 자극 항체의 항암 기전을 분석하기 위하여 동종 마우스 암 세포인 CT26을 피하 투여하는 고형암 모델을 도입하였다. 기존에 GITR 자극 시 천식 및 기생충 질환 모델에서 Th2 반응을 증가시킨다고 알려졌기 때문에 (10) GITR 자극 항체 투여 시 암 환경에서도 Th2 반응을 증가시킬 수 있는지 그리고 항암 작용에 기여할 수 있는지 알아보았다. 그 결과 GITR 자극 항체 투여 시 IL-4, -13 등 체내 Th2 사이토카인의 생성이 증가되었으며, 이들의 수용체가 결핍된 마우스에서 GITR 자극 항체의 항암 효과가 사라지는 것을 확인할 수 있었다 (그림 1).
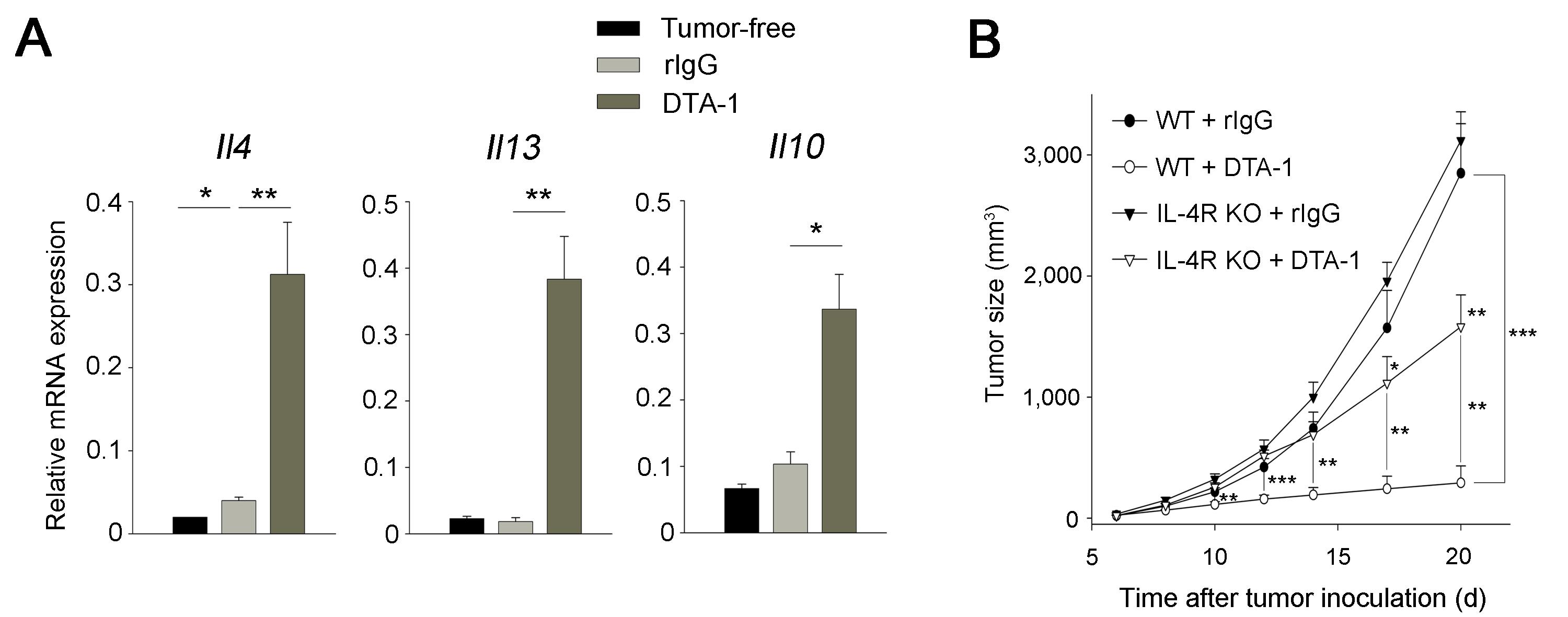
그림 1. IL-4 수용체 신호 전달과 GITR 자극 항체의 항암 작용
(A) CT26 암 세포가 이식된 마우스에 GITR 자극 항체 (DTA-1)를 투여하면 체내 IL-4, -13, -10의 발현이 증가하였고, (B) IL-4 수용체가 결핍된 마우스에서는 GITR 자극 항체의 항암 효과가 유의미하게 감소되었다. (출처: Kim et al., Nat Med. 21(9):1010-7, 2015)
이렇게 항암 효과가 사라진 마우스의 체내에는 특징적으로 IL-9의 생성이 크게 저해되어 있었으며, GITR 자극 항체는 암 이식 마우스에서 빠른 시일 내 IL-9의 발현을 유도하는 것을 알 수 있었다. 이를 중화하였을 때 GITR 자극 항체의 항암 효과가 크게 감소하였으며, 이를 통해 GITR 자극 항체의 항암 작용이 IL-9을 통해 일어난다는 것을 밝혀내었다. 또한, 이러한 IL-9 매개 항암 효과는 고형암에 국한되지 않고 화학 물질과 Oncogene 의해 유도될 수 있는 각각의 대장암과 폐암 모델에서도 나타남을 보여주었다 (그림 2).
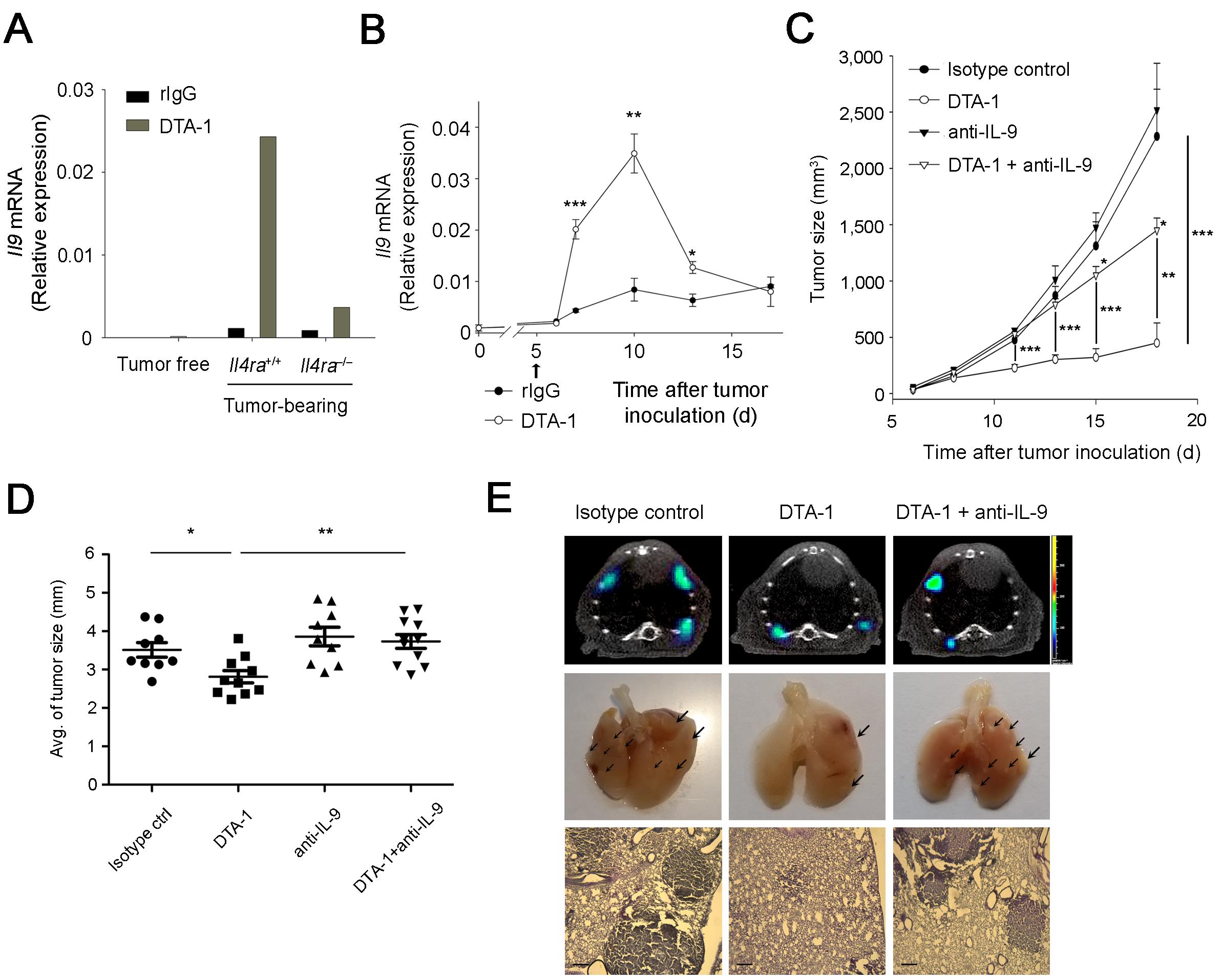
그림 2. IL-9을 매개로 한 GITR 자극 항체의 항암 작용
(A) IL-4 수용체가 결핍된 마우스에서는 IL-9의 발현이 크게 감소되었고, (B) GITR 자극 항체 투여 시 CT26 암세포를 이식한 마우스 체내에서 2일 째부터 IL-9의 발현량이 증가, 5일 후 Peak에 도달한 후 점점 감소되는 패턴을 보였다. GITR 자극 항체의 IL-9 매개 항암 효과를 CT26 고형암 모델 (C), AOM/DSS 유도 대장암 모델 (D), 그리고 KRas Oncogene 유도 폐암 모델 (E) 에서 확인하였다. (출처: Kim et al., Nat Med. 21(9):1010-7, 2015)
2. IL-9에 의한 체내 세포독성 세포 및 수지상 세포의 기능 변화
다음으로 GITR 자극에 의해 유도된 IL-9이 어떻게 항암 반응을 일으킬 수 있는지 알아보았다. 일련의 항암 면역 반응에 의해 암이 제거될 때 암 특이적 세포독성 반응이 중요한 역할을 하는 것이 잘 알려져 있으며 이를 확인해본 결과 GITR 자극 항체가 IL-9 의존적으로 체내 암 특이적 세포독성 반응을 증가시키는 것으로 나타났다. 특히, 세포독성 반응을 주요하게 구성하는 암 특이적 CD8 T 세포가 granzyme B, IFN-γ, TNF-α, 그리고 CD107a을 발현하는 효과 세포로 분화하는데 중요한 역할을 함을 밝혀내었다. 또한, 이 과정에서 수지상 세포의 활성화 및 암 항원의 교차 제시능도 IL-9에 의해 조절됨을 알 수 있었다 (그림 3).
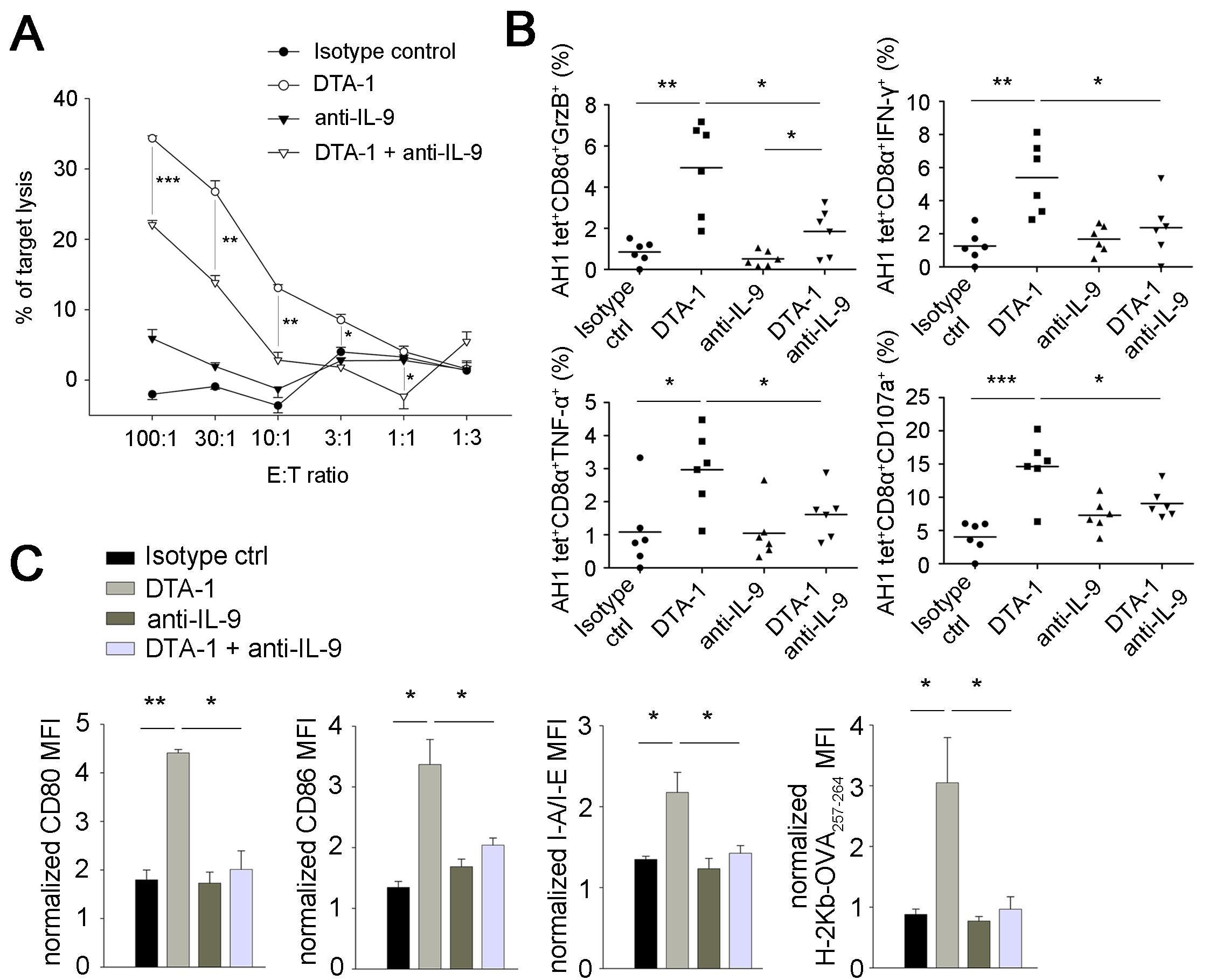
그림 3. 수지상 세포와 세포독성 CD8 T 세포를 통한 GITR 자극 항체의 일련의 항암 반응
GITR 자극 항체 투여로 유도된 체내 IL-9에 의해 암 특이적 세포독성 반응 (A), 암 특이적 CD8 T 세포의 granzyme B, IFN-γ, TNF-α, CD107a 발현 정도 (B), 그리고 암 조직 내 수지상 세포의 활성화 및 암 항원 교차 제시능 (C) 이 조절됨을 보여주었다. (출처: Kim et al., Nat Med. 21(9):1010-7, 2015)
3. GITR 자극에 의한 Th9 세포 분화 증가
지금까지의 결과가 GITR 자극 항체 투여에 따른 체내 IL-9의 증가와 일련의 항암 반응들을 보여주었다면 다음으로 GITR 자극이 직접적으로 IL-9을 생성하는데 관여하는지 CD4 T 세포의 분화적인 측면에서 살펴보았다. 이를 위해 분화하지 않은 전구체 CD4 T 세포를 분리하여 시험관 내에서 분화시켜보았다. 그 결과 분화 과정 중 GITR 자극이 주어지면 IL-9을 생성하는 Th9 세포로의 분화가 증가되는 것을 관찰하였다. 그리고, 놀랍게도 GITR 자극은 항암 면역을 저해할 수 있는 조절 T 세포로의 분화는 감소시키고 이렇게 조절 T 세포로의 분화가 저해된 세포는 Th9 세포로 분화됨을 확인할 수 있었다. 이러한 결과는 마우스뿐만 아니라 인간 CD4 T 세포의 분화에서도 일관되게 확인할 수 있었다 (그림 4).
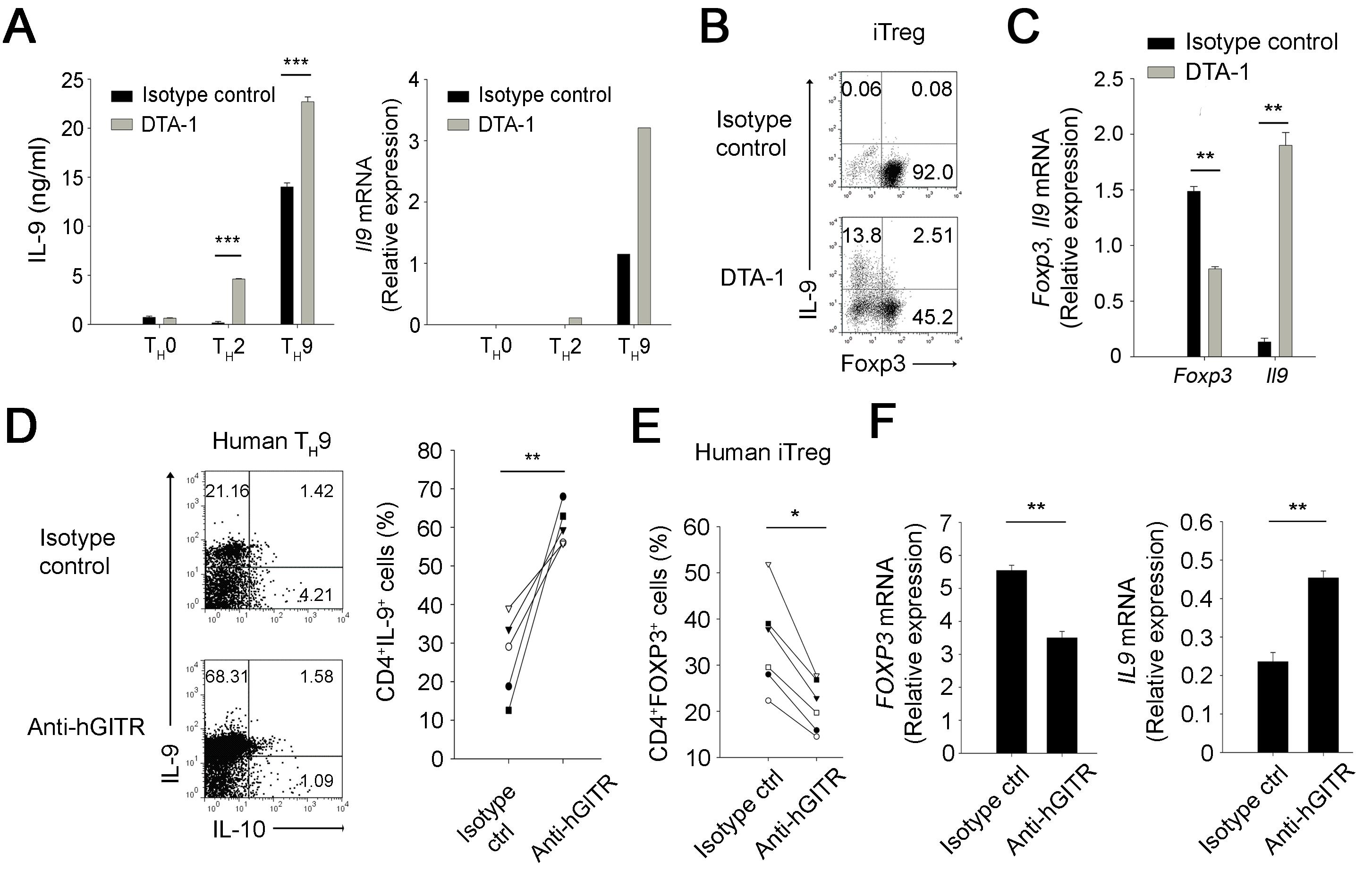
그림 4. GITR 자극에 의한 Th9 및 조절 T 세포 (Treg)의 분화 변화
CD4 T 세포의 분화 과정에서 GITR 자극 시 Th9 세포의 분화는 증가되고 조절 T 세포의 분화는 억제되며, 이 때 조절 T 세포로의 분화가 저해된 세포는 Th9 세포로 분화함을 마우스 (A-C)와 인간 (D-F) CD4 T 세포에서 보여주었다. (출처: Kim et al., Nat Med. 21(9):1010-7, 2015)
4. GITR–TRAF6–NF-κB 경로를 통한 Th9 세포 분화 증가
그러면 어떻게 GITR 자극이 Th9 세포 분화를 증가시킬 수 있었을까? GITR은 TNF(Tumor Necrosis Factor) 수용체 중 하나로 많은 TNF 수용체들이 NF-κB 경로를 통해 하위 신호를 전달하는 것으로 알려져 있다 (10). GITR 자극 또한 Canonical and Noncanonical NF-κB 경로를 활성화시켰으며, NF-κB 특이적 저해제를 분화 과정 중 첨가해주었을 때 Th9 세포로의 분화가 증가되지 않음을 확인할 수 있었다 (그림 5). 또한, NF-κB의 상위 신호 전달 분자인 TRAF(TNF Receptor–Associated Factor) family 중 TRAF6의 발현을 GITR 자극이 증가시켰으며(Data not shown), TRAF6 발현이 특이적으로 결핍된 CD4 T 세포는 GITR 자극이 주어져도 Th9 세포로 분화가 증가되지 않았다 (그림 5). 이를 통해, GITR 자극은 TRAF6–NF-κB 경로를 통해 Th9 세포 분화를 증가시킨다는 것을 알 수 있었다.
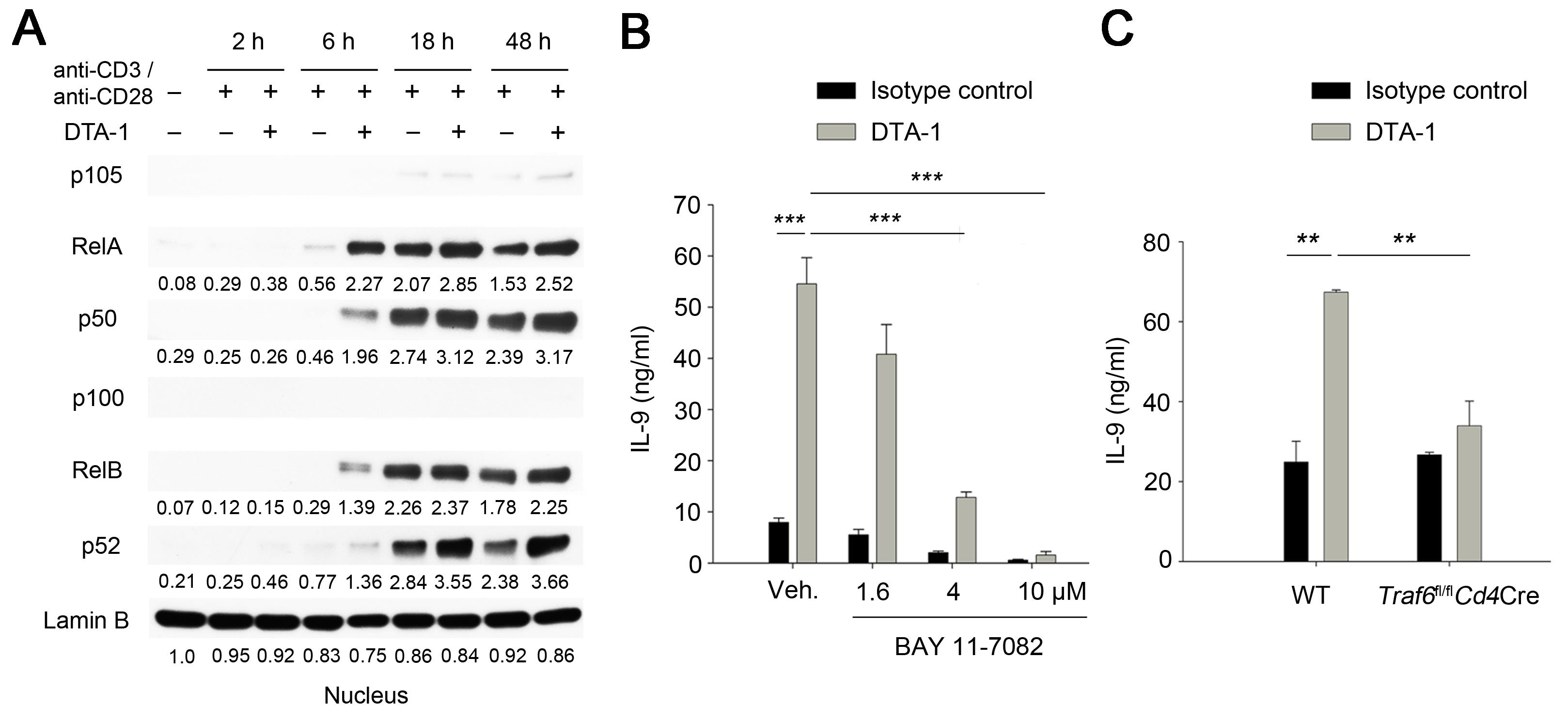
그림 5. TRAF6–NF-κB 경로를 통한 GITR 자극의 Th9 세포 분화 증가
GITR 자극은 Canonical and Noncanonical NF-κB 신호 전달을 활성화시키며 (A), 이렇게 활성화된 NF-κB는 CD4 T 세포에서 IL-9 생성을 증가시키는데 관여함을 NF-κB 저해제 (BAY 11-7082)를 통해 보여주었다 (B). 또한, TRAF6가 특이적으로 결핍된 CD4 T 세포에서 GITR 자극에 의한 IL-9 생성 증가가 보이지 않음을 통해 (C), GITR–TRAF6–NF-κB 축이 Th9 세포 분화에 중요한 역할을 함을 밝혀내었다. (출처: Kim et al., Nat Med. 21(9):1010-7, 2015)
연구의 성과 및 의의
본 연구는 마우스 암 모델에서 GITR 자극 항체의 이전에 알려지지 않은 항암 기전을 새로이 밝혀내었다. 특히 새로운 T 세포 아형인 Th9 세포를 통하여 처음으로 GITR 자극 항체의 항암 기전을 포괄적으로 설명해 주었다. 시험관 내에서는 Th1과 Th2 반응의 길항 작용이 잘 알려져 있지만 체내 암 환경에서는 IL-4 수용체 신호 전달을 통한 IL-9의 발현을 통해 수지상 세포의 활성화와 암 특이적 세포독성 T 세포 반응을 효율적으로 유도할 수 있음을 보여주었고, 이를 통해 강한 항암 작용이 나타나는 것을 알 수 있었다. 또한, GITR 자극은 항암 면역 반응을 억제할 수 있는 조절 T 세포로의 분화 경로를 Th9 세포 쪽으로 바꾸어 항암 반응에 기여할 수 있음을 밝혀내었다 (그림 6).
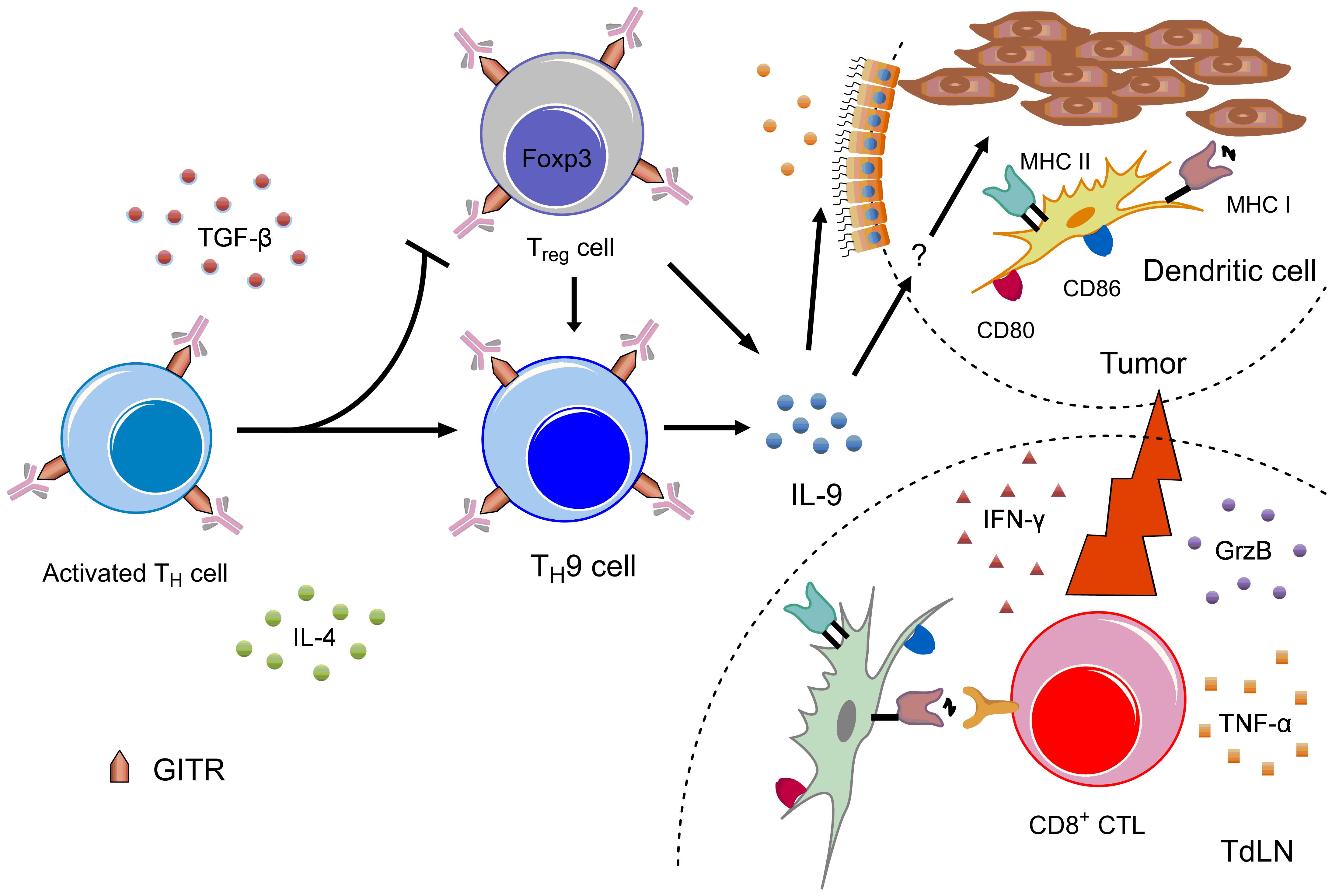
그림 6. GITR 자극 항체의 항암 기전 모식도
CD4 T 세포에 GITR 자극 항체가 결합하면 Treg으로의 분화는 억제하는 대신 Th9 세포로의 분화는 증가시키며 이렇게 생성된 IL-9에 의해 체내 수지상 세포의 성숙 및 암 항원의 교차 제시가 증가하게 되어, 결과적으로 활성화된 암 특이적 CD8 T 세포에 의해 암의 성장이 저해되게 된다. (출처: Kim et al., OncoImmunology 5(5): doi. 10.1080/2162402X.2015.1122862, 2016)
이러한 발견은 아직 많은 것이 밝혀지지 않은 Th9 세포의 발달에 있어서 GITR 자극 자체의 역할을 규명했을 뿐만 아니라 GITR 자극 항체를 항암제로 사용할 때 명확한 항암 기전 제공을 통해 그 이론적 기반을 제공하였다는데 의미가 있다. 그리고 IL-9의 생성을 통한 Th9의 항암 작용이 나타날 수 있다는 사실은 새로운 항암 면역 치료제를 개발하고 평가하는데 매우 중요한 사실이 될 수 있을 것이다.
참고문헌
2. Sliwkowski, M.X. and Mellman, I. (2013) Antibody therapeutics in cancer. Science 341, 1192-1198.
N Engl J Med 369, 122-133.
antibodies. Annu Rev Med 65, 185-202.
Immunity 44, 1069-1078.
effects on tumor-infiltrating Foxp3+CD25+CD4+ regulatory T cells. J Exp Med 202, 885-891.
7. Zhu, J., Yamane, H. and Paul, W.E. (2010) Differentiation of effector CD4 T cell populations.
Annu Rev Immunol 28, 445-489.
differentiation of T helper 2 cells and promotes an interleukin 9-producing subset. Nat Immunol 9, 1341-1346.
9. Purwar, R., Schlapbach, C., Xiao, S. et al. (2012) Robust tumor immunity to melanoma mediated by
interleukin-9-producing T cells. Nat Med 18, 1248-1253.
첨부파일