
생화학분자생물학회입니다.
인체 발생과정과 질환연구를 위한 줄기세포 기반의 3차원 오가노이드
작성자
관리자작성일자
2016-08-01조회수
932인체 발생과정과 질환연구를 위한 줄기세포 기반의 3차원 오가노이드
(Stem Cell-Based 3D Organoids as Models of Human Development and Disease)

손미영
한국생명공학연구원(KRIBB) 줄기세포연구센터
과학기술연합대학원대학교(UST) 기능유전체학과
myson@kribb.re.kr
1. 서론
현대 생물학은 하나의 전능성(Totipotent) 세포에서 복잡한 인체조직으로의 발생과정에 대한 혁신적 이해를 통한 발전을 거듭하고 있다. 배아줄기세포(Embryonic Stem Cell: ESC)와 분화된 체세포로부터 리프로그래밍(Reprogramming) 과정에 의해 만들어진 역분화줄기세포(induced Pluripotent Stem Cell: iPSC)는 자가증식(Self-Renewal) 능력과 인체를 구성하는 세포로 분화가 가능한 전분화능(Pluripotency)을 가지고 있어 난치성 질환, 유전질환 등을 치료할 수 있는 도구로서 각광 받고 있다. 성체줄기세포(Adult Stem Cell: ASC) 역시 유전적 안정성을 가지면서 자가증식능과 다소 제한적인 다분화능(Multipotency)을 가지고 있다. 그러나, 인체 장기 형성에 필요한 세포간 상호작용을 가능하게 하는 적절한 배양 시스템의 부족으로 인해 조직 패턴화(Tissue Patterning) 및 장기 형태발생 과정(Organ Morphogenesis)연구, 인간의 질환 발달과정 연구 등은 여전히 어려움이 많은 실정이다. 하지만, 최근 각광받고 있는 3차원(Three-Dimensional: 3D) 배양 시스템의 발전과 인체와 생리학적으로 유사한 줄기세포-유래의 오가노이드(Organoid)로 불리는 세포집합체 연구를 통해 in vitro 환경에서 장기형성 과정(Organogenesis), 발생과정, 질환연구 등의 가능성을 제시하고 있다. 오가노이드라는 용어는 3차원 세포배양법에 의해 형성된 유사 조직/장기 구조체로써 넓게는 단순 세포집합체인 스페로이드(Spheroid), 다양한 생체재료를 기반으로 한 3차원 세포집합체, 줄기세포나 장기 기원세포-유래의 3차원 장기-특이적 세포집합체 등을 포함한다. 본 보고에서는 오가노이드를 줄기세포의 분화능력과 자기조직화(Self-Organization) 특성을 이용하고, 인간의 자연 발생과정(Natural Development)을 모방하는 3차원 세포배양을 통해 인체 장기의 일부를 모방하거나 유사한 형태로 만든 세포 집합체로 제한한다.
오가노이드 기술은 차세대 연구기술로써 현재의 세포 수준 및 모델 동물을 이용한 연구의 패러다임을 바꿀 잠재력을 가지며, 기초 연구, 신약 개발, 장기 대체 치료법에 이르기까지 최신 연구 분야에 적용이 가능하다. 이러한 오가노이드 기술은 줄기세포 및 재생의학 분야의 핵심적인 기술임에도 불구하고 아직까지 초기 연구단계이므로 기술 집중을 통한 세계 시장 선점이 가능하다. 본 보고에서는 오가노이드 기술의 전세계 최신 연구 동향과 인체 발달과정 및 질환을 이해하기 위한 모델 시스템으로서의 오가노이드의 중요성, 재생의학적 활용을 위해 해결해야 할 과제에 대해 논의하고자 한다.
2. 본론
2-1. 장기/조직 유사체로서의 오가노이드
인간의 조직/장기를 기존의 in vitro 모델 및 동물 모델의 단점을 보완하고, 임상시험 단계의 축소 및 실패율 감소를 통해 비용과 시간을 절감할 수 있는 인체 유사 시스템의 필요성이 증대되고 있다. 특히, 줄기세포 및 관련 융×복합 기술을 활용하여 인체 생리학적인 환경과 기능을 모사함으로써 오가노이드와 같은 3차원 유사 조직/장기 모델 제작 기술 개발이 활발히 진행되고 있다. 전통적인 2차원 배양 시스템과는 다르게 오가노이드는 구성과 구조적인 면에서 일차 조직(Primary Tissue)과 매우 유사하며, 생물체의 모든 조직을 구성하는 세포타입으로 분화할 수 있는 자가증식능을 가진 줄기세포를 포함하고 있다. 또한 오가노이드는 증식이 가능하며, 바이오뱅크(Biobank)에 동결 보관 후 필요할 때 활용할 수 있다. 무엇보다 오가노이드는 단층세포배양(Monolayer Culture) 모델에 비해 인체 조직과 생리학적으로 더욱 유사하며, in vivo 동물/인간 모델에 비해 환경적 인자와 세포신호 전달의 조절 및 유전자 교정(Genome Editing)이 용이하여, 전통적인 2차원 배양과 in vivo 모델 간의 가교 역할을 할 수 있다. 이러한 인체 유사-생리학적 모델로서의 중요성으로 인해 기초연구와 중계연구 모두에서 이용될 수 있는 오가노이드 기술은 학계와 산업계를 아우르는 관심을 받고 있다. 물론, 현재의 오가노이드 기술은 완전한 생체 내 환경을 모방하지는 못하고 있고, 분화인자 규명 및 오가노이드 제작 기술 최적화 등의 해결해야 할 문제점들이 여전히 남아있다.
세포의 자기조직화 능력을 이용하여 일차조직(Primary Tissue)으로부터 3차원 배양이 가능함이 오래 전부터 알려져 있었으나, 2009년 한스 클레버스(Hans Clevers) 연구팀에서 Lgr5+ 줄기세포와 소장(Small Intestine, Gut)의 움(Crypt)으로부터 장기간 배양이 가능한 3차원 구조를 가진 소장 상피세포(Intestinal Epithelium) 유사체를 제작한 이후로부터 오가노이드 기술의 급격한 발전이 있어왔다 (1). 한스 클레버스 연구팀의 장 오가노이드(Intestinal Organoid)는 움 구조와 융털(Villus) 구조를 가지고 있는 인체의 소장 조직과 유사한 구조를 가지고 있으면서, 소장 줄기세포와 소장을 구성하는 다양한 분화 세포를 모두 가지고 있다. 최근에는 일차조직-유래의 오가노이드 제작 시스템이Lgr5+ 줄기세포를 가지고 있는 대장, 위, 간 등의 다른 조직-특이적인 오가노이드 제작에도 적용 가능함이 보고되고 있다 (2-4). 이러한 성체 조직 유래의 오가노이드와 더불어 태아 조직 유래의 폐 오가노이드도 개발되어 폐 발달과정 연구 모델로 제안되고 있으며 (5), 환자의 종양 조직과 순환 종양 세포를 통해 일차 종양 조직과 유사한 환자-특이적 종양 오가노이드 모델도 개발되고 있다 (6).
2-2. 줄기세포 기반 오가노이드 연구의 최신 동향
오가노이드 연구는 일차조직 유래 세포로부터 주로 수행되어 왔으나, 최근에는 인간 역분화줄기세포를 포함하는 전분화능을 가진 줄기세포로부터 인체의 발생과정을 모사하는 분화 기법을 통한 오가노이드 연구가 활발하게 진행되고 있다. 이러한 연구는 인체로부터 확보하기 힘든 일차 세포 및 조직을 사용하지 않고도 오가노이드 제작이 가능하다는 관점에서 더욱 그 중요성이 강조된다. 특히, 2013년 환자의 역분화줄기세포로부터 미니 뇌(대뇌 유사기관; Cerebral Organoid)가 만들어진 후 그 연구가 더욱 활발히 진행되고 있다. 이후 간, 위, 장관, 폐 등 다양한 전분화능 줄기세포-유래 오가노이드 개발 성과가 증가되고 있다 (그림 1). 인체 장기 모델을 제작하는데 문제점 중 하나는 인체 장기-유래 세포의 원활한 공급인데 무한증식 능력을 가지고 있는 전분화능 줄기세포(배아 및 역분화줄기세포 포함)의 경우, 이로부터 대량의 분화세포의 확보가 가능한 장점이 있다. 또한, 거의 모든 세포로 분화 할 수 있는 분화능을 가지므로 침습적인 조직 채취과정 없이 더 효율적으로 충분한 양의 오가노이드를 제작할 수 있다. 그러므로 환자의 역분화줄기세포 및 체세포복제 배아줄기세포(Nuclear Transfer-Derived ESC: NT-ESC)-유래 오가노이드 제작을 통해 향후 개인 및 환자 맞춤형 3차원 조직/장기 모델 및 세포치료제 개발로의 기술 활용이 가능하며, 특히 전분화능으로 인해 특정 환자의 유전적 배경을 가지는 모든 종류의 장기-특이적 오가노이드의 제작이 가능하다. 따라서, 본 보고에서는 현재 주목받고 있는 인간 전분화능 줄기세포 기반의 오가노이드 개발 주요 성과에 대해 기술하였다.
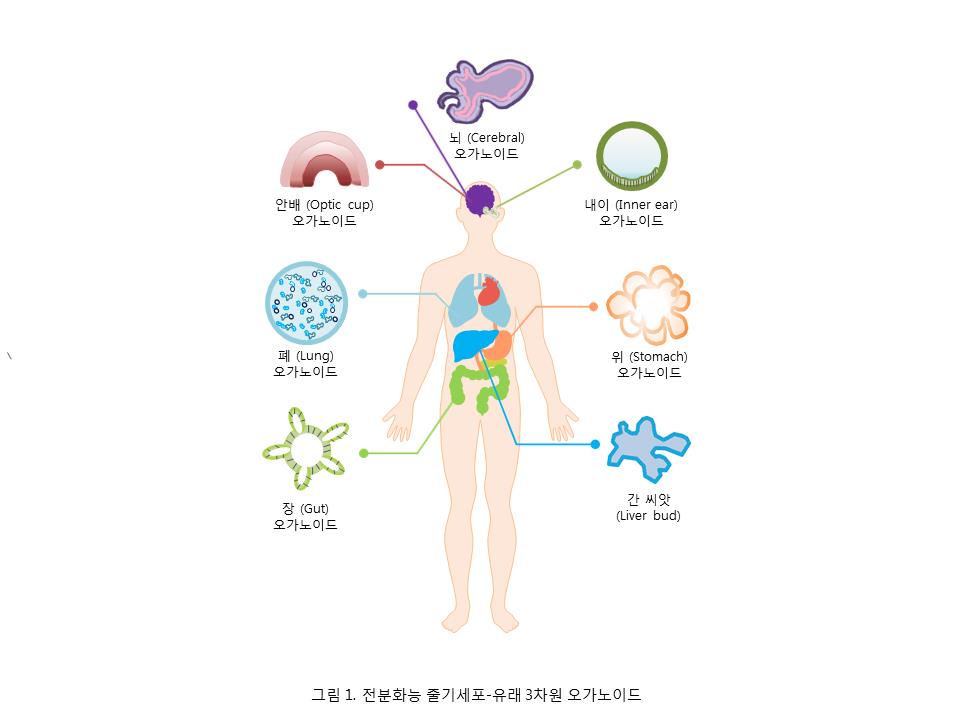
1) 뇌 오가노이드
오스트리아 분자생명공학연구원 등의 공동연구팀은 소두증 환자의 피부에서 얻은 역분화줄기세포를 이용해 환자-맞춤형 ‘대뇌 오가노이드(Cerebral Organoid)’를 제작하여 질환원인 규명 가능성을 제시하였다 (7). 대뇌 피질 영역에 방사형 교세포(Radial Glial Cell)와 신경세포가 존재하며 인간 뇌와 일부 유사한 발달과정을 보여주었으나 혈관 체계 재현 등의 결과는 보여주지 못하는 수준이었다.
2) 신장 오가노이드
솔크 생물학연구소 연구팀(미국)에서 인간 역분화줄기세포로부터 신장 오가노이드 제작에 성공함으로써 3차원 신장 조직을 구축한 최초의 사례이며, 특히 cisplatin과 같은 약물의 독성 스크리닝에 활용될 수 있음을 보여 주었다 (8). 신장은 여러 종류의 조직이 섞여 있는 복합장기로서 손상 시 이식이 필요한 장기이기 때문에 이 사례는 향후 환자 맞춤형 신장 치료 기술에 활용될 수 있다.
3) 간 오가노이드
요코하마시립대 연구팀(일본)에서 인간 역분화줄기세포를 간전구세포로 분화시킨 뒤 혈관생성세포와 얻은 간엽세포를 섞어 배양해 다세포 세포복합체(Multicellular Spheroid)를 제작함으로써 3차원 ‘간 씨앗(Liver Bud)’을 제작하였다 (9). 그러나 간 씨앗의 증식이나 in vitro에서의 기능성은 현저히 떨어졌고 구조적으로 성체의 간 조직을 모방하지는 못하는 한계점을 보였다.
4) 장관 오가노이드
2009년 한스 클레버스(Hans Clevers) 연구팀(네덜란드)에서 생검조직으로부터 분리한 줄기세포로부터 인체와 유사한 3D Crypt-Villus 구조를 가지는 장관 오가노이드 제작이 가능함을 보고하였으나, 주변 Mesenchyme, 면역 세포 등이 결여되어 있는 한계점이 있었다 (1). 이후 미국 신시내티 아동병원 연구팀(미국)에서 인간 전분화능 줄기세포를 이용해 장관 오가노이드를 제작하였다 (10). 하지만 아직까지 성체의 장관만큼 성숙(Maturation)되지 않은 태아 장관의 특성(Fetal-Like Character)을 보이며, 면역 반응이 결여되어 있는 등의 한계점이 있다 (11).
5) 위 오가노이드
신시내티 아동병원 연구팀(미국)에서 인간 역분화줄기세포세포로부터 3차원 구조의 위장 내부 조직을 제작함으로써, 위장관련 조직 형성의 최초사례로서 위장관계 질병 연구에 활용될 것으로 기대된다 (12). 생성한 3차원 ‘위 조직’에 헬리코박터 균을 주입하는 등의 자극 시 실제 위와 유사한 반응을 보였다.
6) 폐 오가노이드
미시간 의과대학(미국) 등의 공동 연구팀에 의해 인간 역분화줄기세포로부터 호흡기의 상피세포와 유사한 폐 오가노이드를 제작하였으며, 폐에서 보이는 세포들과 폐포와 유사한 형태가 관찰되었다 (13). 태아의 폐와 유사한 유전자 발현 패턴을 보여주고 있어 폐 발달과정, 성숙 기전 및 질환 모델로써 활용이 가능하다.
7) 안배 오가노이드
RIKEN연구소(일본)의 사사이 박사팀은 2011년 생쥐 전분화능 줄기세포로부터 안배(Optic Cup) 오가노이드 연구 결과를 발표한 이후, 2012년에는 발생 초기 안배와 유사한 구조를 보이는 한계점을 가지고 있으나 인간 전분화능 줄기세포로부터도 안배 오가노이드 제작에 성공하였다 (14, 15).
상기에 기술한 바와 같이 전분화능 줄기세포로부터 특정 오가노이드를 제작하기 위해서는 목적세포로 분화하기 위한 조직-특이적 패터닝 인자 및 분화 인자를 적용해야 하며, 세포외 기질복합체인 매트리젤(Matrigel)에 포매(Embedding)하는 과정을 통해 3차원 구조의 원하는 오가노이드를 제작할 수 있다. 하지만 일차조직으로부터 제작된 오가노이드와 비교했을 때 특정 조직으로 분화과정에서 원하지 않는 세포 타입이 섞여 있을 수 있으며, 전분화능 줄기세포 유래의 장관, 위, 신장 등의 오가노이드는 간엽세포(Mesenchymal Cell)들이 존재함이 보고되고 있다 (10, 16). 특히, 이러한 오가노이드의 배양, 증식을 위해서는 줄기세포 미세환경(Stem Cell Niche)과 조직-특이적 세포 신호전달 과정의 이해 및 세포 분화와 유지를 위한 인체 환경과 유사한 성장인자와 신호물질의 농도구배가 필수적이다. 이를 위해 정확한 분화인자 탐색, 세포 환경을 위한 기질(Substrate)과 세포외 기질(Extracellular Matrix: ECM) 연구, 인체와 유사한 농도구배를 위한 마이크로유체 시스템(Microfluidic System) 등의 연구 필요성이 증대되는 추세이다. 향후 줄기세포 기반 오가노이드 기술은 단순히 오가노이드를 제작하는 수준에서 기능성을 가지는 인체 모사 장기를 제작하기 위한 연구를 통해 더욱 높은 활용도와 파급효과가 있을 것으로 기대된다.
2-3 오가노이드 기술의 활용
인체와 유사한 생리학적 특징을 가지면서도 배양과 증식이 가능한 3차원 오가노이드는 인체 조직/장기 모델로서 기초와 중계연구를 아우르는 넓은 범위에서 다양하게 활용될 수 있다. 작은 양의 초기 세포로부터 조직-특이적 줄기세포와 분화세포로의 3차원 분화가 가능한 오가노이드 시스템을 통해 발생학적 기초연구, 줄기세포 연구, 미세환경 인자 발굴, 병원균과 인체의 상호작용 연구, 질환 모델 연구, 인공 바이오장기 개발, 세포치료제 연구를 위한 원천기술로 활용될 수 있다.
1) 기초연구를 위한 인체 모델
오가노이드 시스템은 배아 발생, 계통 특수화 과정(Lineage Specification), 조직 항상성 및 질환의 원인과 증상에 관한 연구에 활용할 수 있다. 미분화 상태의 전분화능 줄기세포나 태아의 조직으로부터 제작된 오가노이드는 원래의 발달 단계를 그대로 유지하고 있고, 세포의 분화를 연구자가 목적에 따라 조절할 수 있어 실험실 내 연구모델로서 매우 유용하다. 또한, 목적 세포의 기능성 분화과정을 모니터링 하면서 줄기세포의 발달과정과 미세환경에 대한 기전 연구가 가능하다. 이와 같이, 줄기세포의 특성 및 발생학적 접근법을 이용한 오가노이드 기술은 기초연구부터 신약개발 활용과 장기 대체 등 재생의학적 적용까지 광범위한 영역에서 활용이 가능하다.
2) 오가노이드를 이용한 질환 모델링과 신약 개발
동물과 다른 인간 특이적 대사과정 연관 질환이나 퇴행성 뇌질환 등은 동물을 통해서 질환 모델링을 하는 것이 매우 어렵다. 따라서 환자-특이적 질환 표현이 가능한 역분화줄기세포와 조직/장기의 기능을 구현하거나 인체 모방 모델을 재현할 수 있는 3차원 오가노이드 기술을 접목하면 맞춤형 인체 조직/장기와 유사한 인간 질환 모델로 활용이 가능하다. 유전적 질환, 암, 감염성 질환, 퇴행성 질환을 포함하는 광범위한 질환 모델로 개발할 수 있으며, 유전자 교정 기술을 이용하면 다양한 질환-특이적 유전자 변이를 도입할 수도 있다. 무엇보다 증식능을 가지고 있는 줄기세포 기반의 오가노이드 모델은 대용량 고집적 스크리닝(High-Throughput and High-Content Screening)에 적합하다. 인체의 조직/장기와 유사한 특성과 기능성을 가진 오가노이드는 약물 유효성/독성 및 안정성 평가 등의 신약개발 중개연구에 활용이 가능하다. 또한, 다양한 인체 조직과 장기를 결합시킨 복합 오가노이드 배양시스템을 활용하여 인체와 유사한 다장기 환경을 구현함으로써 전신성 독성(Systemic Toxicity) 연구도 가능하다.
3) 오가노이드의 재생의학적 활용 가능성
손상된 조직을 동종세포이식(Allogenic Transplantation)을 통해 건강한 조직으로 바꿀 수 있으나, 건강한 공여 조직의 부족과 면역거부반응 문제 등으로 인해 새로운 대체 조직의 필요성이 증대되고 있는 추세이다. 오가노이드 기술을 이용하면 적은 양의 조직으로부터 증식이 가능한 이식용 조직을 보다 효율적으로 확보할 수 있다. 특히 역분화줄기세포 제작 기술을 이용하면 동종(Isogenic) 혹은 조직적합성항원(Human Leukocyte Antigen, HLA)이 일치하는 조직-특이적 오가노이드를 제작할 수 있어 그 활용도는 더 높아질 수 있다. 유전적 질환을 가진 환자의 오가노이드는 유전자 교정 기술을 통해 건강한 동종 조직을 제작함으로써 동소성 이식(Orthotopic Transplantation)도 가능하다. 실제로 손상된 조직을 대체하기 위해 in vitro에서 배양한 오가노이드를 대장, 췌장, 간 등에 동소성 이식 후 기능성 생착이 보고되는 등 재생의학 관점에서의 연구가 활발하게 진행되고 있다 (17-20).
2-4 오가노이드 기술의 미래
오가노이드 기술의 활용을 통해 연구목적으로 사용되는 실험동물 감소 및 기존 방법을 통해 소요되는 연구기간, 자본 및 인력을 획기적으로 절감함으로써 신약개발 효율화에 기여할 것으로 기대된다. 또한, 기존 세포 자원 부족 문제를 해결하고 나아가 면역거부반응이 해결된 개인별 맞춤형 재생의학 기술 분야의 획기적 발전에 기여할 수 있을 것으로 전망된다. 멀지 않은 미래에는 난치성 질환 중 하나인 당뇨의 치료를 위해 기능성의 베타세포를 가지고 있는 췌장 오가노이드 이식술이 이용될 수 있고, 간경화 치료를 위해 간 오가노이드 이식술이 사용될 수 있을 것이다. 또한, 파킨슨 질병이나 척수 손상을 가진 신경 퇴행성질환 환자의 치료를 위해 인체와 유사한 기능성과 생리학적 특징을 가진 신경 오가노이드를 이용할 수 있을 것이다. 그러나 보다 적극적인 오가노이드의 임상적 활용을 위해서는 동물-유래 성분을 포함하지 않은(Xeno-Free) 조건에서 오가노이드를 제작하고 배양해야 하며, 생쥐 육종(Sarcoma)-유래의 매트리젤을 3차원 지지체로 사용하는 대신 규명된 세포외 기질을 이용하는 등의 현실적인 활용을 위한 다양한 연구가 선행되어야 할 것이다.
3. 결론
3 차원 배양 시스템의 발전은 복잡한 인체의 장기를 실험실 수준에서 제작할 수 있게 하고 이식용 조직의 제작도 가능하게 하였다. 여기에 전분화능 줄기세포를 이용하면 이론적으로 모든 종류의 장기와 유사한 오가노이드를 제작할 수 있으므로 다양한 질병에 이용이 가능하며, 리프로그래밍 기술을 적용하면 환자-맞춤형의 오가노이드를 생산할 수 있어 인간 발달과정 연구, 질환 연구, 치료법 개발 분야에서 높은 활용도와 파급효과가 기대된다. 줄기세포를 이용한 다양한 종류의 오가노이드 제작 및 배양 기술이 활발하게 연구되고 있으나 인체 시스템을 대체할 만한 수준의 기능성 오가노이드 개발 측면에서는 아직까지 초기 연구단계 수준이다. 해외의 연구 결과에 비해 국내 연구는 다소 뒤쳐져 있어 세계적인 수준을 극복하기 위한 노력과 지속적인 연구지원이 필요하다.
4. 사사
이 성과는 2016년도 미래창조과학부의 재원으로 한국연구재단의 지원을 받아 수행된 연구임 (No. 2016R1A2B4013501).
5. 참고문헌
1. Sato, T., Vries, R.G., Snippert, H.J. et al. (2009) Single Lgr5 stem cells build crypt-villus structures in vitro
without a mesenchymal niche. Nature 459, 262-265.
2. Barker, N., Huch, M., Kujala, P. et al. (2010) Lgr5(+ve) stem cells drive self-renewal in the stomach and build
long-lived gastric units in vitro. Cell Stem Cell 6, 25-36.
3. Sato, T., Stange, D.E., Ferrante, M. et al. (2011) Long-term expansion of epithelial organoids from human colon,
adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology 141, 1762-1772.
4. Huch, M., Dorrell, C., Boj, S.F. et al. (2013) In vitro expansion of single Lgr5+ liver stem cells induced by Wnt-
driven regeneration. Nature 494, 247-250.
5. Mondrinos, M.J., Jones, P.L., Finck, C.M. and Lelkes, P.I. (2014) Engineering de novo assembly of fetal pulmonary
organoids. Tissue Eng Part A 20, 2892-2907.
6. Gao, D., Vela, I., Sboner, A. et al. (2014) Organoid cultures derived from patients with advanced prostate cancer.
Cell 159, 176-187.
7. Lancaster, M.A., Renner, M., Martin, C.A. et al. (2013) Cerebral organoids model human brain development and
microcephaly. Nature 501, 373-379.
8. Xia, Y., Nivet, E., Sancho-Martinez, I. et al. (2013) Directed differentiation of human pluripotent cells to
ureteric bud kidney progenitor-like cells. Nat Cell Biol 15, 1507-1515.
9. Takebe, T., Sekine, K., Enomura, M. et al. (2013) Vascularized and functional human liver from an iPSC-derived
organ bud transplant. Nature 499, 481-484.
10. McCracken, K.W., Howell, J.C., Wells, J.M. and Spence, J.R. (2011) Generating human intestinal tissue from
pluripotent stem cells in vitro. Nat Protoc 6, 1920-1928.
11. Finkbeiner, S.R., Hill, D.R., Altheim, C.H. et al. (2015) Transcriptome-wide Analysis Reveals Hallmarks of Human
Intestine Development and Maturation In Vitro and In Vivo. Stem Cell Reports. S2213-6711(15)00122-8.
12. McCracken, K.W., Cata, E.M., Crawford, C.M. et al. (2014) Modelling human development and disease in pluripotent
stem-cell-derived gastric organoids. Nature 516, 400-404.
13. Dye, B.R., Hill, D.R., Ferguson, M.A. et al. (2015) In vitro generation of human pluripotent stem cell derived
lung organoids. Elife 4.
14. Eiraku, M., Takata, N., Ishibashi, H. et al. (2011) Self-organizing optic-cup morphogenesis in three-dimensional
culture. Nature 472, 51-56.
15. Nakano, T., Ando, S., Takata, N. et al. (2012) Self-formation of optic cups and storable stratified neural retina
from human ESCs. Cell Stem Cell 10, 771-785.
16. Takasato, M., Er, P.X., Chiu, H.S. et al. (2015) Kidney organoids from human iPS cells contain multiple lineages
and model human nephrogenesis. Nature 526, 564-568.
17. Dekkers, J.F., Wiegerinck, C.L., de Jonge, H.R. et al. (2013) A functional CFTR assay using primary cystic
fibrosis intestinal organoids. Nat Med 19, 939-945.
18. Fordham, R.P., Yui, S., Hannan, N.R. et al. (2013) Transplantation of expanded fetal intestinal progenitors
contributes to colon regeneration after injury. Cell Stem Cell 13, 734-744.
19. Huch, M., Bonfanti, P., Boj, S.F. et al. (2013) Unlimited in vitro expansion of adult bi-potent pancreas
progenitors through the Lgr5/R-spondin axis. EMBO J 32, 2708-2721.
20. Huch, M., Gehart, H., van Boxtel, R. et al. (2015) Long-term culture of genome-stable bipotent stem cells from
adult human liver. Cell 160, 299-312.
첨부파일