
생화학분자생물학회입니다.
소포체 스트레스와 대사질환 (The endoplasmic reticulum stress and metabolic diseases)
작성자
관리자작성일자
2018-08-01조회수
2114

1. 서론
최근 서구화된 식단과 비활동적인 생활 방식의 영향으로 비만(BMI,
kg/m2, 30 이상)과 과체중(BMI
25 이상)을 가지고 있는 사람의 비중이 급격히 증가하고 있다. 미국의 경우 2010년 조사 결과 비만을 가지고 있는 성인의 비중이 36%, 과체중을 가지고 있는 사람들은 절반을 훨씬 넘는 69%를
차지하고 있는 것으로 밝혀졌다. 비만은 단지 미국만의 문제가 아닌데,
2014년 세계보건기구(WHO)의 조사에 따르면 거의 다섯 명 중에 두 명(39%)의 세계 인구가 과체중이고 다섯 명의 한 명꼴로(18%) 비만인
것으로 밝혀졌다. 비만의 문제가 중요한 이유는 비만이 여러 질병들, 특히
나이가 들어감에 따라 나타나는 노화 관련 질병들을 일으키는 중요한 요인 중에 하나이기 때문이다. 비만이나
과체중은 고혈압(Hypertension), 심장 질환(Cardiovascular
Diseases), 이상지질혈증(Dyslipidemia), 그리고 대장암이나 췌장암 같은
암 질환의 발병에 영향을 주는 것으로 나타났고, 제2형 당뇨병의
주원인으로 밝혀져 있다. 이 모든 질환들이 노화와 관련된 질환이어서 수명연장의 걸림돌일 뿐만 아니라, 또한 수명연장에 수반되는 삶의 질을 유지하는데 장애가 되고 있다. 우리나라
및 일본, 중국을 비롯한 아시아권은 비만 정도가 서구에 비해 낮아도 비만에 의해 나타나는 질환들이 많이
나타나는 것으로 조사되어 있는데, 실제로 미국의 경우 2014년
당뇨병을 앓고 있는 사람들이 9%에 달하는데 반해 우리나라의 경우 서구 기준의 비만을 가지는 사람들의
비중은 훨씬 낮음에도 불구하고 2016년 현재 30세 이상의
당뇨병 환자(주로 제2형 당뇨병)가 전체 인구의 14%를 차지해서 미국과 비교해서 비만으로 인한 당뇨병
환자는 우리나라가 오히려 높은 것으로 나타나고 있다. 이는 우리나라를 비롯한 동아시아도 비만, 그리고 비만에 의한 대사질환의 문제가 심각함을 보여준다.
비만과 이로 인한 제2형 당뇨병을 비롯한 다양한 대사 질환을
일으키는 분자적 그리고 생리적 기작을 이해하는 것은 이러한 질환을 예방 그리고 치료하는데 크나큰 중요성을 안고 있음에도, 이러한 질병들에 대한 현재의 이해 수준은 아직 기초적 단계에 머물러 있다. 최근
미토콘드리아 스트레스(Mitochondrial Stress)나 소포체 스트레스(Endoplasmic Reticulum Stress)와 같은 세포 내 스트레스가 세포 대사와 생리뿐만 아니라
전체 신진대사와 생리에 중요한 영향을 미친다는 것이 본인을 비롯한 전 세계 연구자들에 의해 밝혀지기 시작됐다. 예를
들면 증가된 소포체 스트레스가 대사 조절에 중요한 조직인 시상하부, 간, 지방조직에서 확인되었고 유전적으로나 화학물질을 이용해서 소포체 스트레스를 줄이면 비만, 당뇨, 죽상동맥경화증(Atherosclerosis)과
같은 대사 질환을 상당 부분 완화한다는 것이 동물 실험뿐만이 아니라 사람을 대상으로 한 임상 실험에서도 밝혀졌다
2. 비만과 제2형
당뇨병
비만 및 이로 인한 다양한 대사질환의 경우 우리 몸의 대사 항상성 유지에 실패했을 때 일어난다. 체중 조절의 경우 지방조직에서 분비되는 렙틴(Leptin)을 비롯해서
위에서 분비되는 Ghrelin, 장에서 분비되는 CCK(Cholecystokinin)
등 다양한 호르몬 및 신경 연결을 통해 이루어진다. 그중 대표적인 체중 조절 호르몬인 렙틴은
지방조직 세포에서 주로 합성 및 분비가 이루어지는데, 혈액 속으로 분비된 렙틴은 궁극적으로 뇌의 시상하부에
존재하는 두 가지 다른 신경세포군인 AgRP 및 POMC 신경세포에
작용해서 음식 섭취를 억제하고 열발산을 촉진함으로써 체중 감소를 유도하게 된다. 렙틴을 통한 체중 조절
항상성 기전이 존재함에도 현재 비만이 급증하는 이유는 과영양과 운동부족이 렙틴 저항성을 유도하기 때문인데, 렙틴의
뇌 속으로의 전달에 문제가 있거나 시상하부의 렙틴 수용체 및 관련 신호전달계에 문제가 생길 때 렙틴 저항성이 야기된다고 보고 있다.
혈당 및 당 대사는 인슐린이란 호르몬을 통한 항상성 기전에 의해 이루어지는데, 기본적으로 음식 섭취 시 증가한 혈당을 췌장의 베타세포가 인식하고 이에 따라 인슐린 분비를 증가시키면 인슐린은
간, 근육, 지방조직에 있는 인슐린 수용체에 결합하여 간으로부터의
추가적인 당 생합성(Gluconeogenesis)을 억제하고 동시에 근육과 지방조직으로 혈당을 흡수하도록
촉진함으로써 혈당을 낮춘다. 과영양과 운동부족은 위에서 언급했듯이 비만의 원인이 되는 렙틴 저항성을
일으키기도 하지만 간, 근육, 지방조직에서 인슐린 수용체
관련 신호전달계에 문제를 일으킴으로써 인슐린 저항성 및 제2형 당뇨병을 일으킨다. 인슐린 저항성으로 인해 인슐린의 기능이 약화되면 이를 상쇄하기 위해 보다 많은 인슐린 분비가 이루어져야 하는데
(Hyperinsulinemia), 췌장의 베타세포가 이를 감당하지 못해서 베타세포의 기능저하 및 베타세포
숫자가 감소하게 되면 제2형 당뇨병 환자들도 제1형 당뇨병
환자와 같이 인슐린 주사를 통해 혈당을 조절해야 한다.
비만과 제2형 당뇨병의 원인이 되는 렙틴 저항성 및 인슐린 저항성의
원인이 무엇인지에 대한 연구는 전 세계적으로 활발히 진행이 되고 있으나, 아직 치료에 이용할 만한 성과는
나오지 않고 있는 실정이다. 최근 진행되고 있는 많은 연구들은 비만과 제2형 당뇨병과 같은 대사질환들이 대사적으로 중요한 뇌(시상하부), 간, 근육, 지방조직의
세포 내 항상성 유지에 문제가 있을 때 나타나는 세포 내 스트레스(Intracellular Stress)에
의해 발병하고, 이들 세포 내 스트레스를 경감시키면 질환이 완화된다는 것을 밝힘으로써 세포 내 스트레스
관련 신호전달계들이 대사질환 치료에 이용될 수 있음을 보여준다 (2-4).
3. 소포체 스트레스(ER Stress)와 미접힘단백질 반응(Unfolded Protein
Response, UPR)
세포 내 스트레스는 산화 스트레스(Oxidative Stress), 미토콘드리아
스트레스, Heat Shock Stress, 소포체 스트레스(Endoplasmic
Reticulum Stress, ER Stress) 등이 있다. 이중 소포체 스트레스는
직접적으로는 소포체 내에서 3차 구조 형성에 문제가 있는 분비단백질이나 막단백질들이 축적됨으로써 발생하나, 비만이나 제2형 당뇨병의 원인이 되는 과영양 상태 또한 대사 중요
조직인 시상하부, 간, 지방조직에 특히 소포체 스트레스를
유도한다는 것이 밝혀졌다.
세포는 세포 내 스트레스가 발생하면 신호전달계를 이용해서 세포 내 항상성을 유지하려고 하는데, 소포체 스트레스의 경우 이를 미접힘 단백질 반응(Unfolded Protein
Response, 줄여서 UPR)이라고 한다. 동물세포에서는
소포체에 존재하는 세 종류의 막단백질들에 의해 UPR이 시작되는데, 이들은
PERK(Protein Kinase RNA-like ER Kinase), IRE1(Inositol-Requiring
Protein-1), ATF6 (Activating Transcription Factor-6)이다
(그림 1)
PERK은 소포체 스트레스가 없는 상태에서는 GRP78과 결합해서 단일분자(Monomer)로 존재하고 있다가, 소포체 스트레스 하에서 GRP78가 PERK으로부터 떨어지면 Homodimer를 형성하면서 자가인산화(Autophosphorylation)가
일어난다. 자가인산화가 된 PERK은 eIF2a(Eukaryotic Initiation Factor
2a)의 인산화를 통해 전반적인 단백질 번역(Protein Translation)을 억제하는데, 이는 항상성 유지가
안되는 소포체에 계속적인 신규 단백질 공급을 줄임으로써 소포체의 부담을 줄이는 역할을 한다. 전반적인
단백질 번역의 억제하에서도 uORF(Upstream Open Reading Frame)들을 가지는 ATF4와 같은 특정 전사 인자(Transcription Factor)들은
소포체 스트레스 하에서 단백질 번역이 오히려 증가한다. ATF4는 아미노산 대사, 산화스트레스 관련 유전자들의 발현을 조절할 뿐 아니라 지속적인 소포체 스트레스 하에서는 CHOP(C/EBP Homologous Protein) 발현 증가를 통해 세포사멸(Apoptosis)을 일으킨다.
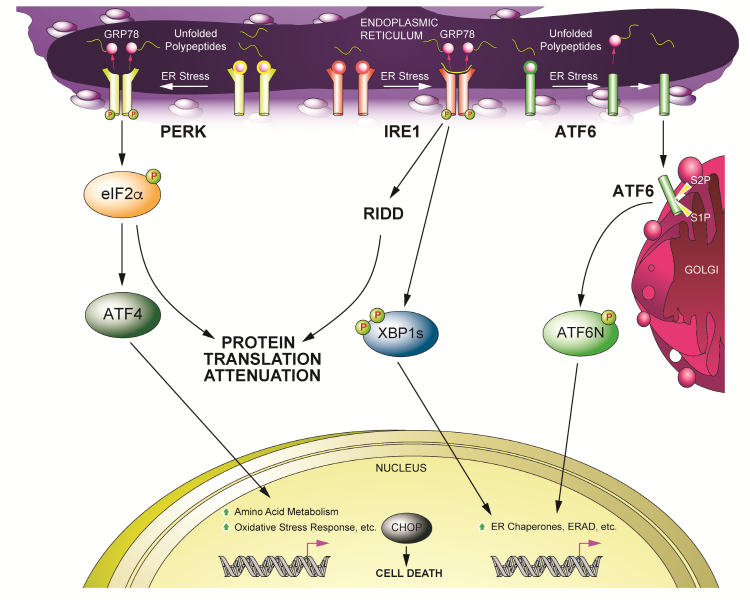
그림 1. 미접힘단백질 반응(Unfolded
Protein Response, UPR)
Lee and Ozcan, 2014, J Biol Chem에서 변경 (1)
IRE1은 PERK과 동일한 기전을 통해 소포체 스트레스가 없는 상태에서
단일분자로 존재하고 있다가, 소포체 스트레스 하에서 Homodimer
및 Polymer를 형성한다. 또한 소포체 스트레스
하에서 축적된 미접힘 단백질과의 직접 결합을 통해서도 Homodimer 및 Polymer를 형성할 수 있다. PERK과 유사하게 Homodimer 및 Polymer 형성과 동시에 자가인산화가 일어나지만, 다음 단계로의 신호전달은 인산화가 아닌 IRE1이 가지는 RNase 기능을 통해 이루어진다. IRE1은 이 RNase 기능을 이용해서 XBP1 mRNA(Yeast에서는 HAC1 mRNA)를 핵 밖의 소포체 표면에서 Splicing을 일으키고, Spliced XBP1(sXBP1 또는 XBP1s) mRNA로부터
형성된 XBP1s 전사 인자는 핵으로 이동해서 타깃 유전자 발현을 증가시킨다. IRE1은 RNase 기능을 통해 XBP1(또는 HAC1) mRNA Splicing뿐 아니라 세포질에
존재하는 다양한 microRNA 또는 mRNA들의 분해를
유도해서 세포 내 기능에 관여하고, 이를 RIDD(Regulated IRE1-Dependent
Decay)라고 한다.
ATF6는 전사 인자이지만 막단백질이라 핵으로의 이동을 못하고 소포체에 머물고 있다가, 소포체 스트레스 하에서는 골지(the Golgi)로 이동을 해서
골지에 있는 단백질 절단 효소인 S1P(Site-1 Protease)와 S2P에 의해 막으로부터 전사 인자 기능을 하는 도메인이 분리된다. 그리고
절단된 ATF6는 핵으로 이동해서 타깃 유전자 발현을 증가시킨다.
S1P과 S2P는 지방과 콜레스테롤 생합성에 관여하는 전사 인자들인 SREBP1/2의 활성에도 관여한다. ATF6와 XBP1s는 소포체 항상성 회복에 관여하는 유전자들의 발현을 증가시킴으로써 소포체 스트레스를 경감시킨다.
4. 소포체 스트레스, UPR Interactome과 대사조절
비만과 제2형 당뇨병을 가지는 동물 모델에서 뇌의 시상하부, 간 그리고 지방세포 등 대사조절에 중요한 역할을 하는 조직들에게서 증가된 소포체 스트레스가 관측됨으로써 소포체
스트레스가 대사질환들의 원인이 될 가능성이 제기되었다. 나아가서 소포체 스트레스 감소 효과가 있다고
보고된 4-Phenylbutyric Acid(4-PBA)나 Tauroursodeoxycholic
Acid(TUDCA) 같은 화합물들(이들을 Chemical
Chaperone이라 칭함)을 제2형 당뇨병
동물 모델에 처리하면 고혈당(Hyperglycemia), Glucose Intolerance, 인슐린
저항성 등의 제2형 당뇨병 관련 증세들이 완화되고, 렙틴
저항성을 가진 동물 모델에서도 Chemical Chaperone을 처리하면 렙틴에 대한 반응성이 증가되는
것이 보고되었다 (3, 4). 비록 소규모였지만 사람에 대한 실험을 통해서
4-PBA와 TUDCA 투약이 인슐린 저항성 극복에 도움이
된다는 것 또한 확인되었다. 결국 이들 일련의 실험 결과들은 소포체 스트레스 완화가 효과적인 대사질환
치료에 이용될 수 있다는 가능성을 시사한다.
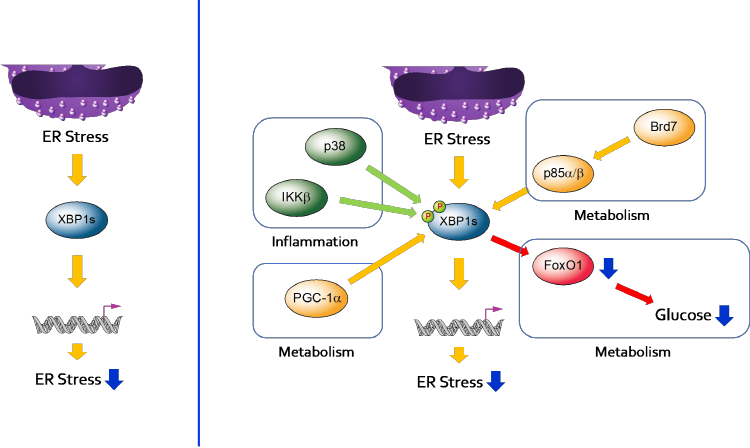
그림 2. XBP1s 상호작용체(XBP1s
Interactome)
소포체 스트레스, 특히 UPR 신호전달계가
어떻게 대사조절에 관여하는가에 대한 연구를 통해 UPR 신호전달계와 다른 신호전달계들과의 상호작용, 즉 UPR Interactome을 통해 대사조절에 관여한다는 것이
밝혀지게 되었다. 소포체 스트레스는 항염증반응을 증가시키는데, 이는
스트레스 하에서 IRE1이 TRAF2(TNF Receptor-Associated
Factor-2)와 Protein-Protein Interaction을 하고 이를 통해
JNK(c-Jun N-terminal Kinase)
활성을 증가시키기 때문이다. 또한 간에서 ATF6는
CRTC2(CREB-Regulated Transcription Coactivator-2)와 Protein-Protein Interaction을 하고 이를 통해 CRTC2의
활성을 억제함으로써 당 생합성을 낮춘다 (5). XBP1s도 간에서 당 생합성에 관여하는 전사 인자인
FoxO1(Forkhead Box Protein O1)을 Protein-Protein
Interaction을 통해 단백질 분해를 촉진함으로써 FoxO1에 의해 유도되는 당 생합성을
억제한다 (6). 비만인 동물 모델의 간에서 증가된 소포체
스트레스에도 불구하고 ATF6와 XBP1s의 활성이 저하되어
있고, 이들의 활성을 다시 증가시켜 주면 인슐린 저항성 관련 증세들이 완화되는 것 또한 확인되었다. XBP1s의 경우 전사 인자로 기능하는 도메인이 없어도 FoxO1 조절을
통한 당 항상성에 관여하는 것으로 봐서 XBP1s과 다른 신호전달계 인자와의 Protein-Protein Interaction이 당 대사 조절의 주된 기전으로 보인다. 또한 이후의 연구들을 통해 p38 MAPK, PI3K (Phosphoinositide
3-Kinase) p85 Regulatory Subunit, PGC-1a, IKK1b 등 항염증과 대사조절에 관여하는 신호전달계
인자들이 XBP1s의 활성을 Protein-Protein Interaction을
통해 조절하는 상위 조절 인자로 밝혀졌다 (그림 2) (1, 7). 이는 소포체 스트레스 관련 UPR 신호전달계 인자들이 서로 다른 Interactome 형성을 통해
다양한 생리조절에 관여함을 보여준다.
5. 결과
비만 그리고 비만에 의한 대사질환은 현재 우리나라를 비롯한 세계의 심각한 건강 문제로 대두되고 있으나 효과적인 치료법들은
아직은 제한적이다. 소포체 스트레스 및 다른 세포 내 스트레스들이 많은 질병들의 원인이 된다는 보고들은
계속 증가 중이고, 관련 기전에 대한 연구 또한 많이 진행되고 있다.
흥미로운 것은 소포체 스트레스에 관여하는 UPR 신호전달계가 다른 신호전달계와의 상호작용체(Interactome) 형성을 통해 다양한 생리대사 조절에 관여한다는 것이다.
이와 같은 연구들을 통해 축적된 정보들은 향후 비만과 당뇨병과 같은 대사질환을 비롯해서 세포 내 스트레스에 의해 발병되는 다른 많은
질환들의 효과적인 치료법 개발에 유용하게 이용될 것으로 기대한다.
참고문헌
1. Lee, J. and
Ozcan, U. (2014) Unfolded protein response signaling and metabolic diseases. J Biol Chem 289, 1203-1211.
2. Ozcan, U., Cao, Q.,
Yilmaz, E., Lee, A. H., Iwakoshi, N. N., Ozdelen, E., Tuncman, G., Gorgun, C.,
Glimcher, L. H. and Hotamisligil, G. S. (2004) Endoplasmic reticulum stress
links obesity, insulin action, and type 2 diabetes. Science 306, 457-461.
3. Ozcan, U., Yilmaz,
E., Ozcan, L., Furuhashi, M., Vaillancourt, E., Smith, R. O., Gorgun, C. Z. and
Hotamisligil, G. S. (2006) Chemical chaperones reduce ER stress and restore
glucose homeostasis in a mouse model of type 2 diabetes. Science 313, 1137-1140.
4. Ozcan, L., Ergin, A.
S., Lu, A., Chung, J., Sarkar, S., Nie, D., Myers, M. G., Jr. and Ozcan, U.
(2009) Endoplasmic reticulum stress plays a central role in development of
leptin resistance. Cell Metab 9,
35-51.
5. Wang, Y., Vera, L.,
Fischer, W. H. and Montminy, M. (2009) The CREB coactivator CRTC2 links hepatic
ER stress and fasting gluconeogenesis. Nature
460, 534-537.
6. Zhou, Y., Lee, J.,
Reno, C. M., Sun, C., Park, S. W., Chung, J., Lee, J., Fisher, S. J., White, M.
F., Biddinger, S. B. and Ozcan, U. (2011) Regulation of glucose homeostasis
through a XBP-1-FoxO1 interaction. Nat
Med 17, 356-365.
7. Lee, J., Salazar
Hernandez, M. A., Auen, T., Mucka, P., Lee, J. and Ozcan, U. (2018) PGC-1alpha
functions as a co-suppressor of XBP1s to regulate glucose metabolism. Mol Metab 7, 119-131.
첨부파일