
생화학분자생물학회입니다.
기능적 microRNA Targeting 규칙의 포괄적 발굴
작성자
관리자작성일자
2017-01-01조회수
865기능적 microRNA Targeting 규칙의 포괄적 발굴
General rules for functional microRNA targeting Nat Genet. 48(12):1517-1526, 2016


김도연 백대현
서울대학교 생명과학부 서울대학교 생명과학부
rlaehdus0918@snu.ac.kr baek@snu.ac.kr
연구배경
microRNA(miRNA)는 ~22 nucleotide(nt)의 길이를 갖는 단일 가닥 RNA 분자로서, Argonaute 단백질(AGO)과 복합체를 이뤄 Target mRNA의 3’UTR에 결합하여 해당 유전자의 발현을 억제하는 미세 조절자 역할을 한다 (1, 2). 최소 60%에 달하는 인간 mRNA들이 miRNA의 조절을 받고 있으며 암을 비롯한 여러 질병과도 관련이 되어있는 중요한 생체 내 조절자 역할을 수행한다 (3).
miRNA는 Target mRNA를 Watson-Crick Nucleotide 결합을 통해 인식한다. 이 때, 6 Nucleotides의 Seed 지역이 중요하다고 알려져 있으며 이를 바탕으로 miRNA가 Target mRNA를 억제하는 4가지 유형의 표준적 결합규칙(Canonical Site Type, CST)들이 실험을 통하여 입증되었다 (4). 이에 더하여, AGO 교차 결합과 면역 침강을 응용한 고성능 염기서열 결정법(Argonaute Crosslinking and Immunoprecipitation Followed by High-Throughput Sequencing, AGO CLIP-seq) 등의 생화학적 접근법을 통해 몇 가지 비표준 결합규칙(Non-Canonical Site Type, NST)들이 보고된 바 있다 (5). 그러나 이들 선행 연구들은 다음과 같은 명백한 한계가 존재한다. 먼저 AGO CLIP-seq을 이용한 연구의 경우 miRNA와 Target mRNA 사이의 결합에 대한 정보는 제공하지만, 결합한다는 사실만으로는 해당 mRNA의 발현이 실제로 억제된다고 보장하기 어렵다. 또한, miRNA와 인간 mRNA들 사이에는 실로 무수히 많은 유형의 결합 형태가 일어날 수 있음에도 불구하고 선행연구들은 이들 중 극소수의 결합규칙들에 대해서만 검증을 시도했다.
위와 같은 한계로 인해 선행 연구들이 제안한 여러 NST들이 실제로 동작하는지에 대해 학계에서 논쟁이 계속되고 있는 실정이다. 따라서, 본 연구진은 miRNA 과발현에 의한 전사체의 직접적인 반응을 관찰한 Microarray 데이터에 기반하여 20억개 이상의 miRNA-mRNA 결합규칙을 발굴하고 이들의 기능을 검증하는 연구를 시작하게 되었다.
연구결과
1. 거대규모 miRNA-mRNA 결합규칙 분석을 위한 Pipeline 개발
miRNA와 mRNA 사이에서 일어날 수 있는 모든 결합규칙들에 대해서 해당 결합규칙이Target mRNA의 발현을 억제할 수 있는지 평가하기 위해 miRNA Overexpression에 대한 mRNA들의 발현 양상 변화(Transcriptome Response)를 측정한 Microarray 데이터들을 다량 수집하고, 이를 포괄적으로 분석할 수 있는 생물정보학 분석 파이프라인을 개발했다 (그림 1). 20억 개에 달하는 결합규칙들 각각이 miRNA에 반응하는 mRNA들과 유의미하게 연관되어있는지 분석하기 위한 거대규모 통계학적 분석을 수행했다.
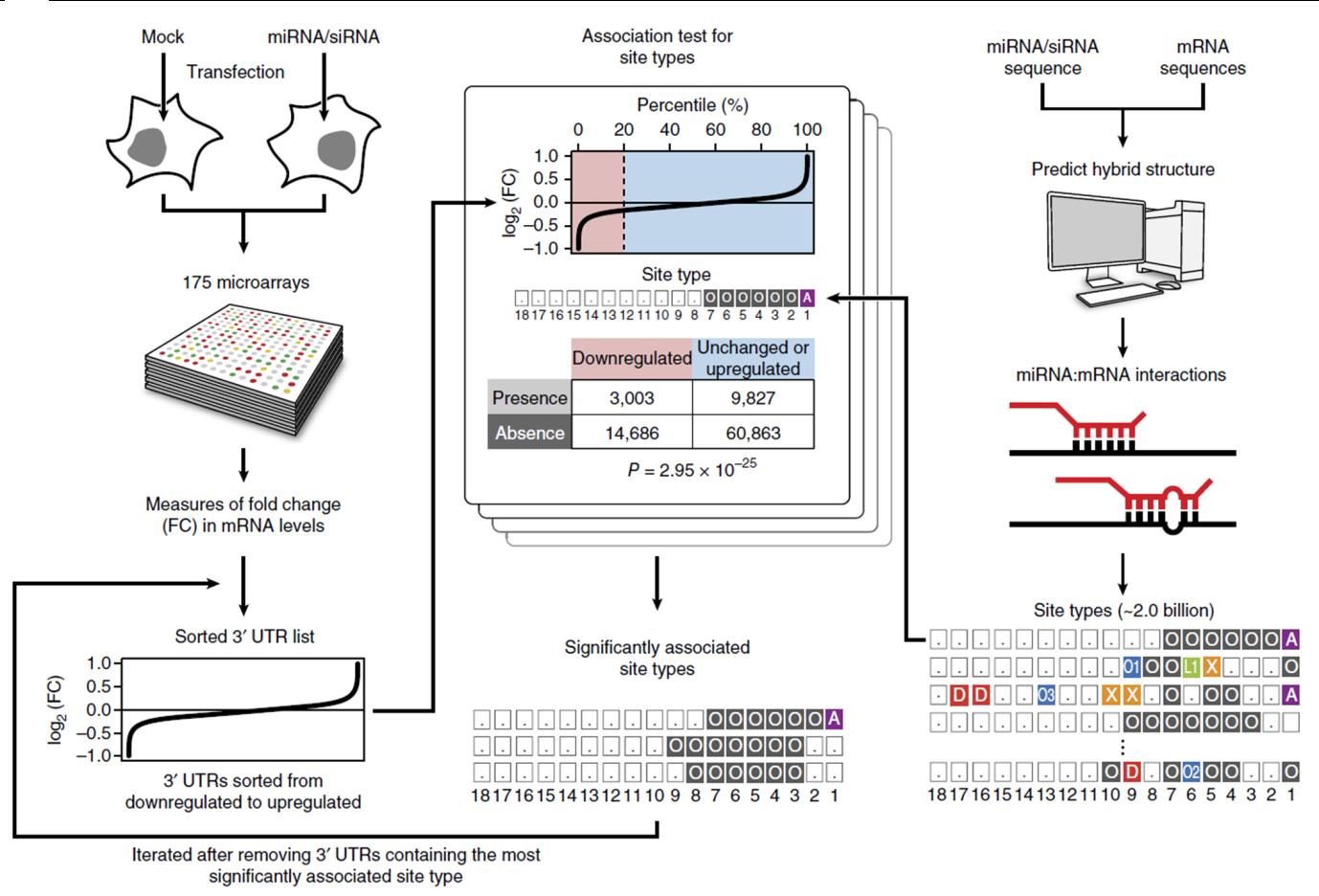
그림 1. 분석 파이프라인의 개괄
포괄적 miRNA Targeting 규칙을 분석하기 위한 파이프라인. miRNA 과발현에 의한 전사체의 반응을 측정한 Microarray Data를 74개 수집한 후, miRNA와 mRNA 사이에 발생 가능한 결합규칙들 각각에 대하여 이들이 miRNA에 반응하는 mRNA들과 유의미하게 연관되어있는지 통계학적 분석을 수행한다.
2. 기능적 비표준 결합규칙(Non-Canonical Site Type, NST) 후보의 발굴
본 연구진이 개발한 분석 파이프라인을 활용하여 20억 개의 결합규칙에 대한 검정을 실시한 결과, 동작한다고 알려진 4개의 CST(그림 2A)들과 함께 3가지의 비표준 결합규칙(Non-Canonical Site Type, NST)들도 발굴할 수 있었다 (그림 2B). 한편, miRNA Target 자리 주변 서열의 AU 함량이나 miRNA-mRNA 결합의 열역학적 안정성 등의 Context들이 miRNA의 Target 발현 억제 능력에 영향을 미치는 것으로 알려져 있다(6). 이에 착안하여, 비록 분석 파이프라인에서는 통계적 검정을 통과하지 못했지만, 우수한 Context에서는 Target mRNA의 발현을 유의미하게 억제하는 Context 의존적 비표준 결합규칙(Context-Dependent Non-Canonical Site Type, CDNST)의 발굴을 시도했다. Context를 고려한 분석을 통해 추가적으로 4가지의 CDNST들을 발굴하여 총 4개의 CST와 7개의 새로운 NST를 발굴할 수 있었다 (그림 3).
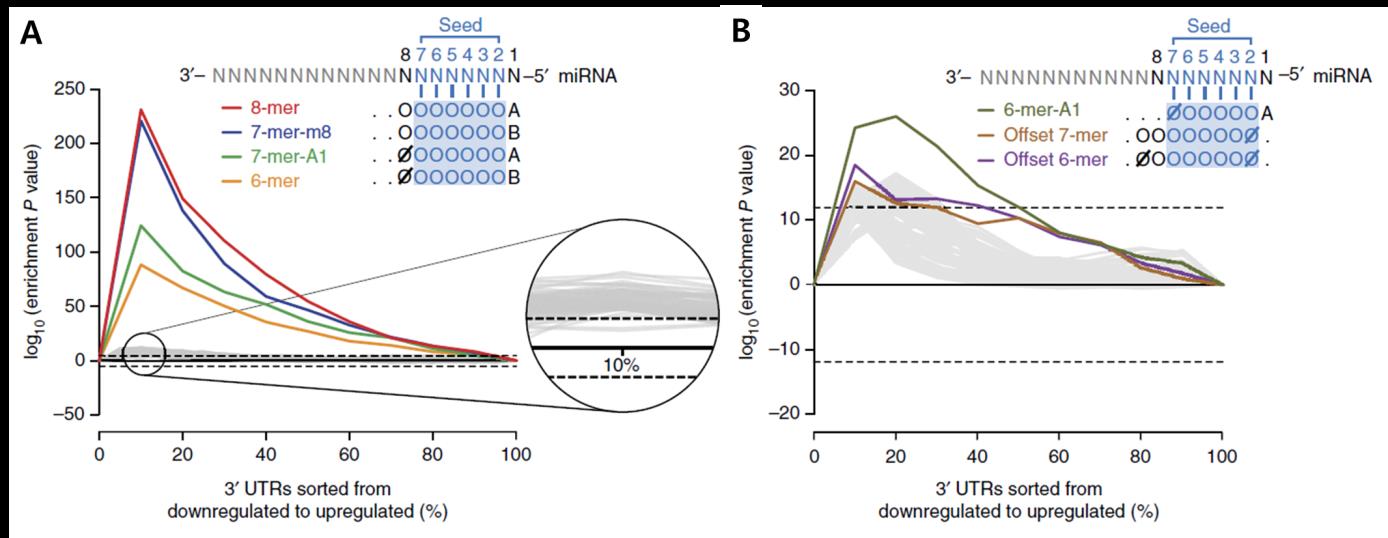
그림 2. 기능적 miRNA 결합규칙의 발굴
분석 파이프라인의 통계 검정 P value가 낮은 순서대로 기능적 miRNA 결합규칙을 발굴한다. (A) CST의 발굴 결과. (B) NST의 발굴 결과.
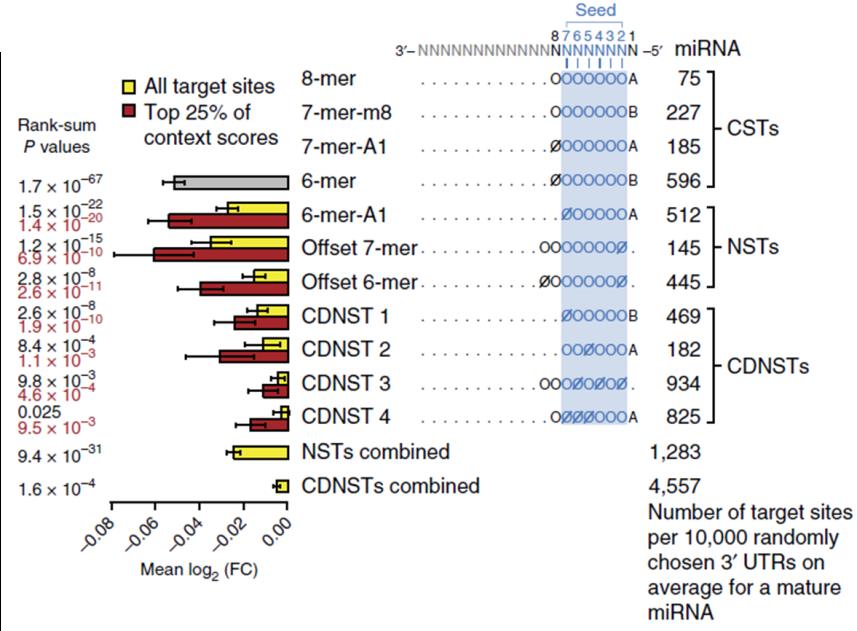
그림 3. 포괄적인 기능적 miRNA Targeting 규칙
분석 파이프라인을 통해 발굴된 CST, NST, CDNST들의 평균 Target mRNA 발현 억제량(log2(fold change) )과 Target mRNA의 갯수. NST와 CDNST는 Target mRNA 발현 억제 능력이 CST보다 약하지만, 좋은 Context의 경우 CST 6mer Site에 필적하는 억제력을 보인다(적색 막대 그래프, Context 상위 25%).
3. 새로운 NST와 CDNST의 기능 검증
본 연구를 통해 발굴한 7개의 NST 및 CDNST들이 실제로 Target mRNA의 발현을 억제하는지 확인하기 위해 실험적 검증을 수행하였다. Luciferase Reporter Assay를 이용하여 3’UTR에 NST Site를 보유한 mRNA 들에 대해 해당 Site로 인한 단백질 발현량 변화를 측정하였다. 각 결합규칙 당 10개의 Target 3’UTR들을 실험했을 때, 2개의 NST들과 2개의 CDNST들을 검증한 결과 총 70%의 Target 단백질들이 유의미하게 발현이 억제되는 것을 관찰할 수 있었다 (그림 4A-D). 4가지 NST, CDNST들의 Target 억제 효과를 대조군 결합규칙과 비교했을 때 역시 유의미한 Target 단백질 발현 억제력의 차이를 확인했다 (그림 4E). 또한 하나의 강력한 CST 8mer site에 대하여 돌연변이를 만들어 다른 세 종류의 CST, 세 종류의 NST 및 네 종류의 CDNST로 순차적으로 치환하였다. 이들의 Target 단백질 억제 정도를 비교한 결과, 기능적 miRNA 결합규칙 발굴에서 유의미했던 순서와 유사하게 Target 단백질의 상대적 발현 억제 능력을 보이는 것을 확인했다 (그림 4F).
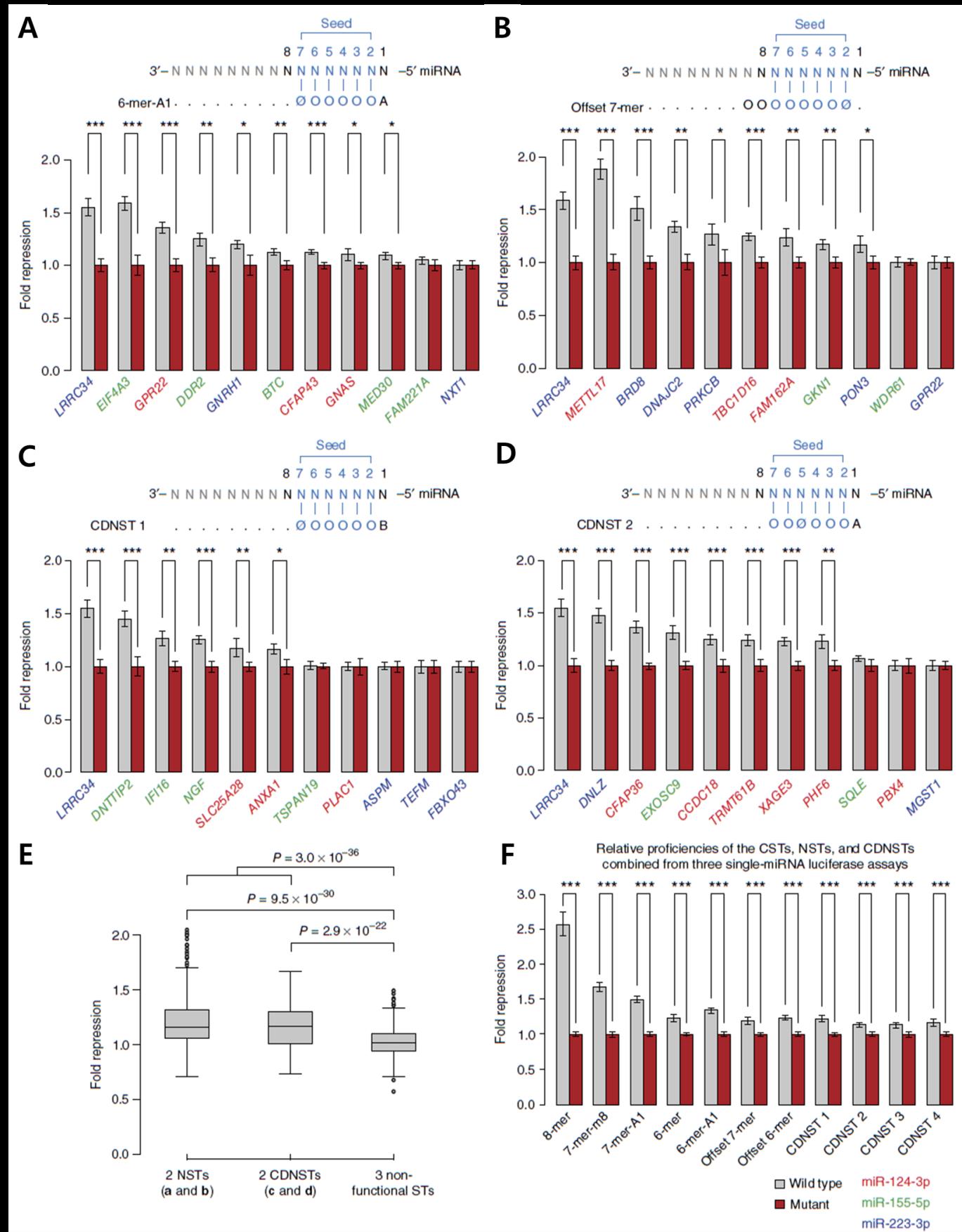
그림 4. Luciferase Assay를 활용한 NST 및 CDNST의 기능 검증
(A-D) HeLa 세포에서 miR-124, miR-155, 혹은 miR-223의 NST와 CDNST Target Site에 의한 Target 단백질의 발현 변화를 측정한 Luciferase Reporter Assay. (A) 6mer-A1 결합규칙. (B) Offset 7mer 결합규칙. (C) CDNST1 결합규칙. (D) CDNST2 결합규칙. (E) 2개의 NST(A, B), 2개의 CDNST(C, D), 그리고 3개의 동작하지 않는 결합규칙들의 Target 단백질 발현 억제량 비교. (F) 하나의 Target Site에 대한 순차적 돌연변이를 통한 각 결합규칙들 간의 직접적인 Target 단백질 발현 억제량 비교.
실험적 검증 외에 독립된 Microarray 데이터를 추가적으로 분석한 결과 역시 본 연구를 통해 발굴된 결합규칙들이 실제 세포 내에서 기능적으로 동작함을 뒷받침 했다. 쥐와 Zebrafish에서 miRNA를 Knock-Out한 데이터(그림 5A), 인간 세포주에서 miRNA를 Knock-Down한 데이터(그림 5B), 그리고 인간 세포주에서 miRNA를 과발현한 데이터(그림 5C) 모두에서 NST와 CDNST의 Target mRNA가 miRNA에 의한 발현 억제를 받고 있음을 확인했다. 특히, miRNA Knock-Out과 Knock-Down 데이터에서의 결과는 endogenous한 세포 환경에서 Target mRNA들이 NST 및 CDNST에 의한 조절을 받고 있다는 것을 의미하므로, 본 연구에서 발굴한 결합규칙들이 생체 내에서 동작하며 생물학적으로도 중요한 역할을 수행함을 암시한다.
분석을 통해 발굴된 NST 및 CDNST Site에 실제로 AGO가 결합하는지 확인하기 위해 CrossLinking, ligAtion, and Sequencing of Hybrids(CLASH, Ref. 7) 데이터와 AGO CLIP-seq(8) 데이터를 분석한 결과, CLASH 데이터의 경우 전체 AGO 결합 Site들 중 61.7%(그림 6A), AGO CLIP-seq 데이터에선 64.8%(그림 6B)가 NST 혹은 CDNST Site에 결합한 것을 관찰할 수 있었다. 이는 miRNA에 의한 Target mRNA 발현 저해에 핵심적인 역할을 하는 AGO가 실제로 NST 및 CDNST Site에 결합함을 의미하며, 따라서 NST 및 CDNST들이 miRNA Targeting에 의한 유전자 조절 메커니즘의 핵심 요소로서 작용할 가능성을 제시한다.
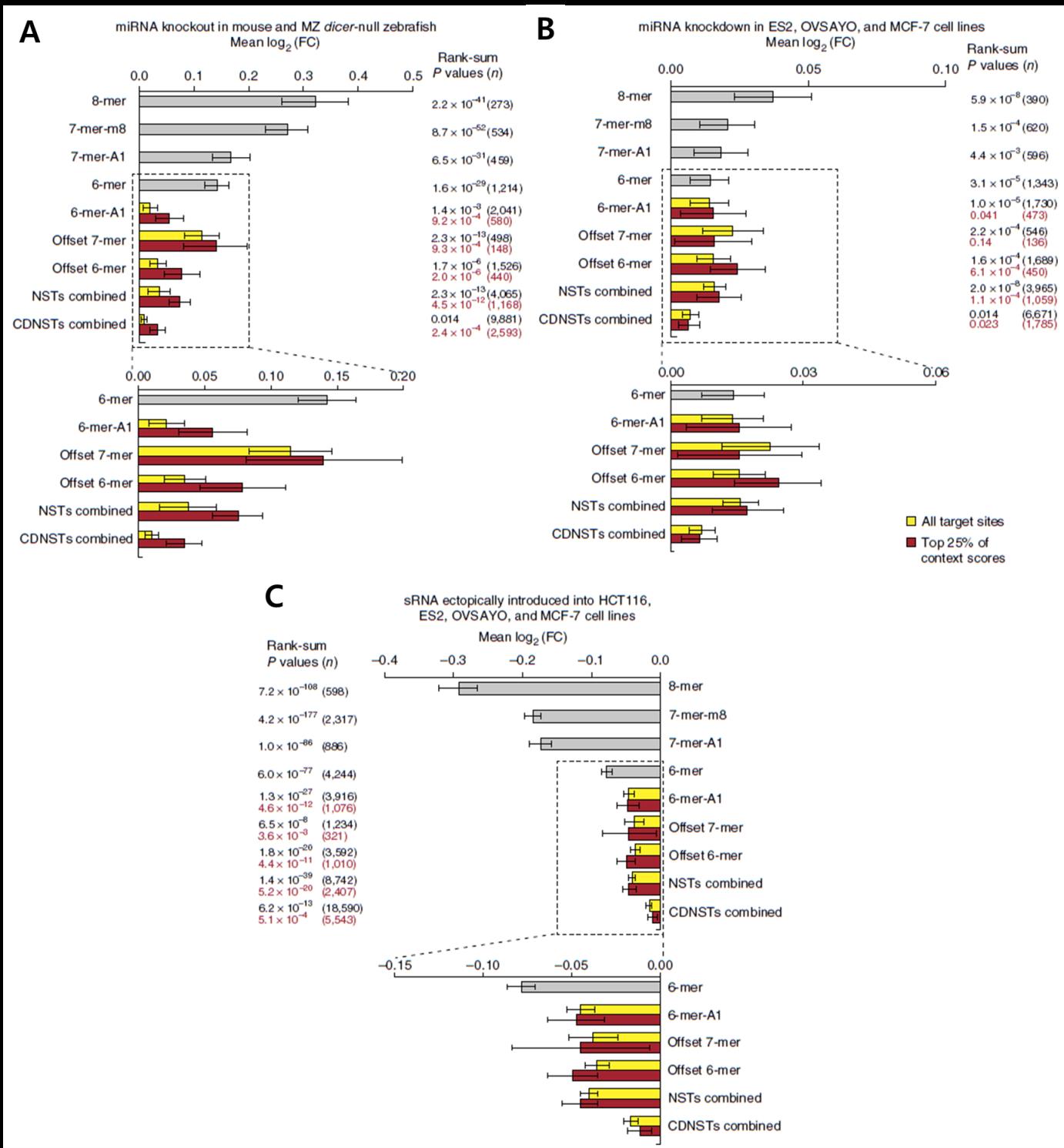
그림 5. 독립적인 Microarray 데이터를 이용한 NST와 CDNST의 검증
(A) 쥐와 Zebrafish에서의 miRNA Knock-Out 실험 Microarray 데이터를 이용한 검증. 각 결합규칙의 평균 Target mRNA 발현 억제량을 측정, 비교했다. (B) 인간 세포주에서의 miRNA Knock-Down 데이터를 이용한 검증. (C) 인간 세포주에서의 miRNA 과발현 데이터를 이용한 검증.
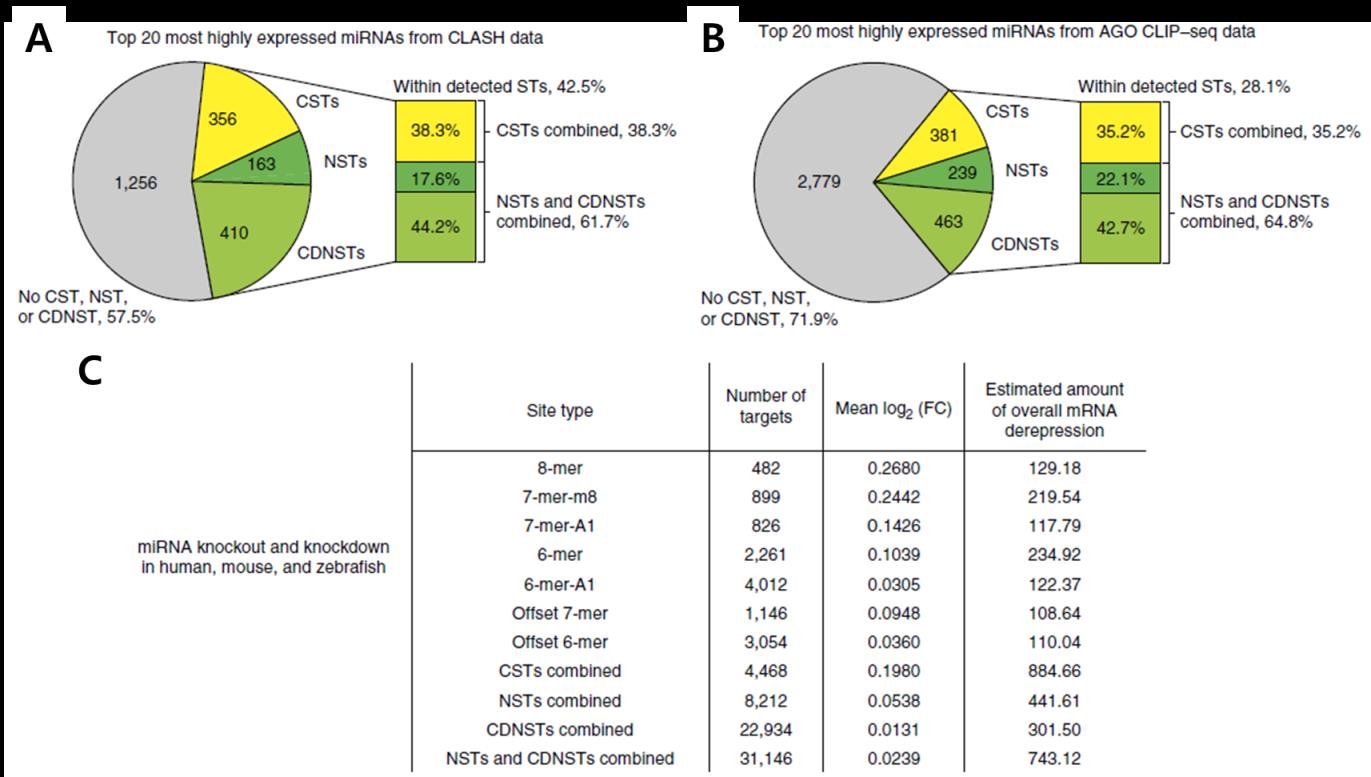
그림 6. NST와 CDNST가 전체 mRNA 억제에 미치는 영향
(A) CLASH 데이터에 포함된 miRNA-mRNA 결합규칙들의 분포. (B) AGO CLIP-seq 데이터에 포함된 miRNA-mRNA 결합규칙들의 분포. (C) 각 결합규칙이 전사체에 미치는 총 발현 억제량의 상대적 비교. 인간 세포주, 쥐, Zebrafish에서의 miRNA Knock-Down 혹은 Knock-Out Microarray 데이터를 이용한 분석한 결과, NST와 CDNST에 의한 총 발현 억제량은 CST의 84%에 달한다.
4. 기능적 miRNA Targeting이 mRNA 발현 억제에 미치는 영향
본 연구를 통해 발굴된 NST와 CDNST들의 생물학적 중요성을 진화적 관점에서 평가하고자 비교 유전체학을 활용한 종간 보존도 분석을 실시했다. 100종의 척추동물 유전체에 대하여 NST 와 CDNST Site를 포함한 3’UTR 서열의 종간 보존도를 상대적으로 비교한 결과 (9, 10), 한 가지 결합규칙을 제외한 모든 NST 및 CDNST들의 Target Site들의 3’UTR Sequence들이 진화적으로 더 보존되어있다는 사실을 확인했다 (표 1). 위의 NST 검증 분석과 더불어 NST 및 CDNST Site의 진화적 보존은 이들이 생물학적으로 중요한 역할을 담당하고 있음을 암시하는 강력한 증거라고 할 수 있다.
NST와 CDNST들의 Target mRNA 발현 억제 능력을 평가하기 위해 Target의 평균 저해 정도를 측정한 결과, Offset 7mer와 같이 CST와 비등한 효과를 가진 결합규칙도 있었지만 대부분의 NST 및 CDNST들은 CST보다 약한 Target 억제능력을 가지고 있었다 (그림 3). 하지만 NST와 CDNST는 그 Target의 갯수가 CST보다 많기 때문에 전사체 전반에 미치는 영향은 CST에 못지 않을 것이라는 가설을 세웠다. CST, NST, 그리고 CDNST들이 전사체에 미치는 Target mRNA 발현 억제의 총량을 측정한 결과, NST와 CDNST에 의한 억제 효과가 CST에 의한 효과의 84%에 달함을 확인했다(그림 6C). 이는 NST와 CDNST가 전사체에 미치는 영향이 CST에 못지 않게 크며 그 동안 생물학자들이 miRNA에 의한 mRNA 조절을 이해하는데 있어 적지 않은 부분을 놓치고 있었다는 것을 의미한다.

표 1. CST, NST, CDNST들의 진화적 보존
100종의 척추동물 유전체를 통해 종간 보존도를 계산한 PhyloP 점수를 이용하여 각 결합규칙의 Target Site를 포함한 3’UTR Sequence의 종간 보존도를 측정했다. 대조군의 보존도와 비교한 결과, 총 7가지의 NST 및 CDNST 중 6가지가 진화적으로 더 보존되었음을 확인했다. (a: 각 결합규칙에 대하여, Match(O)와 miRNA 첫 번째 자리 Adenine(A)의 Nucleotide 당 보존 점수의 중앙값을 진화적 보존도로 계산했다. b: 컴퓨터 계산의 한계 상, 실제 P value는 10-320 보다 낮을 수 있음에도 불구하고 이와 같이 표기했다. c: 4가지 CDNST에 대하여, Context 상위 25%의 Target Site들을 선정하여 보존도를 계산했다.)
연구의 성과 및 의의
본 연구진이 개발한 생물정보학 분석 파이프라인을 이용하여 miRNA Targeting에 대한 거대규모의 분석을 수행한 결과, 이미 알려진 4가지 형태의 CST들 외에 7 가지의 NST들을 추가로 발굴했으며 이들이 실제로 Target mRNA혹은 단백질을 억제함을 독립된 데이터 분석과 추가 실험을 통해 검증했다. 또한 척추동물 유전체 상에서 상당수의 NST Target Site들이 진화적으로 보존되어있음을 확인했는데 이는 이들 NST들이 생물학적으로 중요한 역할을 담당함을 암시한다. 비록 발굴된 NST들은 기존에 알려진 4가지 CST들보다 Target mRNA의 발현을 억제하는 정도는 약하지만 Target의 갯수가 많아 인간 유전자 발현에 미치는 영향은 CST의 그것과 필적할 정도였다. 본 연구를 통해 그 동안 전례가 없었던 포괄적인 miRNA Targeting 연구를 수행함으로써, miRNA에 의한 인간 유전자 조절 네트워크가 기존에 알려진 것보다 훨씬 복잡하다는 것을 밝혀냈다. 본 연구에서 제시된 포괄적인 miRNA의 기능적 Targeting 규칙들로 인해 miRNA에 의한 유전자 제어 기작에 대해 보다 명확히 이해할 수 있게 되었고 본 연구실에서는 이와 관련한 후속 연구를 진행하고 있다.
참고문헌
1. Bartel, D.P. (2009) MicroRNAs: target recognition and regulatory functions. Cell 136, 215–233
2. Baek, D. et al. (2008) The impact of microRNAs on protein output. Nature 455, 64–71
3. Kasinski, A.L., Slack, F.J. (2011) MicroRNAs en route to the clinic: progress in validating and targeting
microRNAs for cancer therapy. Nat. Rev. Cancer 11, 849–864
4. Lewis, B.P., Burge, C.B., Bartel, D.P. (2005) Conserved seed pairing, often flanked by adenosines, indicates that
thousands of human genes are microRNA targets. Cell 120, 15–20
5. Chi, S.W., Hannon, G.J., Darnell, R.B. (2012) An alternative mode of microRNA target recognition.
Nat. Struct. Mol. Biol. 19, 321–327
6. Garcia, D.M. et al. (2011) Weak seed-pairing stability and high target-site abundance decrease the proficiency of
lsy-6 and other microRNAs. Nat. Struct. Mol. Biol. 18, 1139–1146
7. Helwak, A., Kudla, G., Dudnakova, T., Tollervey, D. (2013) Mapping the human miRNA interactome by CLASH reveals
frequent noncanonical binding. Cell 153, 654–665
8. Kishore, S. et al. (2011) A quantitative analysis of CLIP methods for identifying binding sites of RNA-binding
proteins. Nat. Methods 8, 559–564
9. Friedman, R.C., Farh, K.K.H., Burge, C.B., Bartel, D.P. (2009) Most mammalian mRNAs are conserved targets of
microRNAs. Genome Res. 19, 92–105
10. Pollard, K.S., Hubisz, M.J., Rosenbloom, K.R., Siepel, A. (2010) Detection of nonneutral substitution rates on
mammalian phylogenies. Genome Res. 20, 110–121
첨부파일